
科目: 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:

(1)A、B分别是________、________。
(2)如果Ⅰ是人和动物细胞的主要能源物质,则X的名称是________。
(3)P经________方式形成Ⅳ,连接两个P的化学键的结构简式是________。Ⅳ多种多样,从P分析原因是____________________。
(4)大分子物质Ⅰ~Ⅴ中,具有物种特异性的是________。
(5)由小分子物质X、Y、Z、P生成大分子物质Ⅰ、Ⅱ、Ⅲ、Ⅳ的过程中,有一共同的生成物是________。
(6)相同质量的Ⅴ氧化分解时释放的能量远远多于Ⅰ,原因是Ⅴ中________含量高。
查看答案和解析>>
科目: 来源: 题型:
【题目】蛋白质的生理作用包括 ( )
①构成染色体 ②构成生物膜 ③是人体主要的能源物质 ④构成多种酶 ⑤组成所有激素 ⑥参与体液免疫过程
A. ①②③④B. ①②④⑤C. ②③④⑤D. ①②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列有关说法正确的是
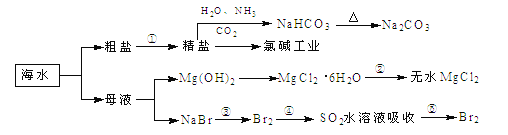
A. 制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl
B. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42-
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.如图为原电池装置示意图。

(1)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,写出B电极反应式:__________。该电池在工作时,A电极的质量将_______(填“增加”“减小”或“不变”),若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为________。
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____________________________。该电池在工作一段时间后,溶液的碱性将________(填“增强”“减弱”或“不变”)。
Ⅱ.现用图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。

(3)b电极材料为________,其电极反应式为_________________________。
(4)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为________mol,此时a电极质量________(填“增加”或“减少”)________g。
(5)如果将a、b两电极的电极材料对调,U形管中将出现的现象是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
![]()
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有误的是(填编号)____,若测定结果偏高,其原因可能是______.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是____________________________。
(3)如下图是某次滴定时的滴定管中的液面,其读数为________mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目: 来源: 题型:
【题目】2014年11月,北京召开APEC会议,期间空气质量一级优,天空被称为“APEC蓝”。为了使“蓝天工程"可持续发展,下列做法正确的是( )
A.直接排放工业废气B.改进汽车尾气净化技术
C.采用焚烧方法处理垃圾D.过度开采和使用化石燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加人4molA和2molB进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=c4(C)c2(D)/[c3(A)c2(B)]
B. 此时,B的平衡转化率是40%
C. 加压,平衡右移,化学平衡常数增大
D. 增加C,B的平衡转化率变小
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知:反应aA(g)+bB(g)cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定前4 s内v(C)=0.05 mol·L1·s1,则该反应的化学方程式为______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L1·s1;乙:v(B)=0.12 mol·L1·s1;丙:v(C)=9.6 mol·L1·min1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为___________(用甲、乙、丙表示)。
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入1~2 滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5 ℃左右冷水的烧杯中;将试管B放入盛有40 ℃左右热水的烧杯中 | 试管A中不再产生气泡试管B中产生的气泡量增大 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未见气泡产生 |
(3)实验①的目的是_______________________________,实验中滴加FeCl3溶液的目的是____________________________。
(4)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是______________________________________________________________(用实验中所提供的几种试剂)。

(5)某同学在50 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如右图所示,则A、B、C三点所表示的即时反应速率最慢的是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池——锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法不正确的是( )
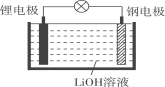
A. 锂为负极,钢为正极B. 工作时负极的电极反应式为Li-e-=Li+
C. 工作时OH-向钢电极移动D. 放电时电子的流向:锂电极→导线→钢电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com