
科目: 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时各物质的浓度有可能是( )
A.X2为0.2 mol·L-1
B.Y2为0.45 mol·L-1
C.Z为0.35 mol·L-1
D.Z为0.4 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式:NaHSO4= Na++H++SO42-
C. Na2CO3的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+ H2O![]() H3O++S2-
H3O++S2-
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为验证SO2的还原性和Fe3+的氧化性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的
(1)确定选择SO2和FeCl3溶液的反应而不选择SO2和Fe(NO3)3溶液的反应来探究,你认为可能是基于什么原因作出的选择:_______________________________________。
(2)将SO2通入FeCl3溶液中,你认为可能观察到的现象是:______________________,你预测的理论依据是(用离子方程式表示):___________________________________。
II.实验探究
(1)配制1mol·L-1FeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_________。
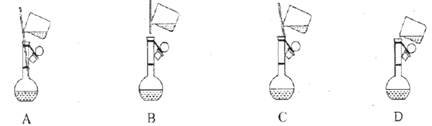
②检测得知溶液呈酸性,其原因是:___________________________(用离子方程式表示)。
(2)将SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知:[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_____________________________________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2,溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,充入气体X和气体Y反应生成气体Z,从反应开始到建立化学平衡,用X、Y、Z分别表示的化学反应速率为v(X)、v(Y)、v(Z)有以下关系:v(X)=3v(Y)、2v(Y)=v(Z),则此反应的化学方程式是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应3X(g)+Y(g) ![]() Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入X:______________;
(5)加入Y:______________;
(6)压缩体积:______________.
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物G是某种药物合成的中间体,其合成路线如下:
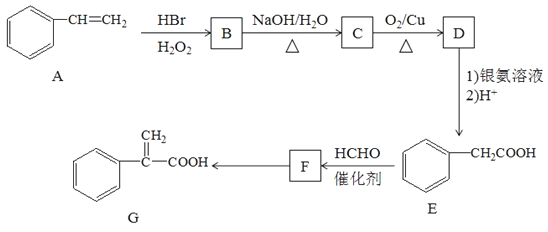
已知:①CH3-CH=CH2+HBr![]() CH3-CH2-CH2Br
CH3-CH2-CH2Br
②CH3COOH+HCHO![]() HOCH2CH2COOH
HOCH2CH2COOH
请回答下列问题:
(1)A的名称为___________________________。
(2)F中官能团名称是______________________________;E转化F的反应类型是_________________。
(3)F转化为G的化学方程式:_________________________________________。
(4)化合物F有多种同分异构体,满足下列条件的同分异构体有__________种。
①属于芳香族化合物且苯环上有两个取代基;
②能发生水解反应和银镜反应;
③与FeCl3溶液发生显色反应。
其中核磁共振氢谱图有6组峰且峰面积之比为1:2:2:2:2:1的有机物的结构简式为__________________;
(5)参照上述合成路线设计一条由CH3CHBrCH3和C2H5OH制备CH3CH2COOC2H5的合成路线(其他试剂自选)______________
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
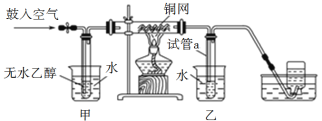
(1)实验过程中铜网出现红色和黑色交替的现象,实际上是发生了两个化学反应,请写出它们的化学方程式_______、______。
(2)甲和乙两个水浴作用不相同。甲的作用是________________,乙的作用是________________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是_______;集气瓶中收集到的气体的主要成分是_______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有________________。要除去该物质,可先在混合液中加入________(填字母),然后再通过蒸馏即可除去。
a 氯化钠溶液 b 苯 c 碳酸氢钠溶液 d 四氯化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的,下图是某工厂从海水中提取镁的主要步骤。学生就这个课题展开了讨论。
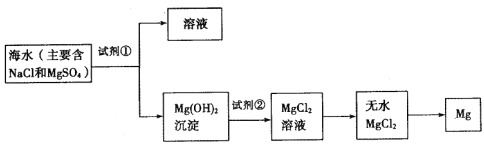
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集,有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
通过分析比较你认为学生_______的观点正确(填学生序号),简述理由:______________________。
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,并充分利用当地的贝壳(主要成分为碳酸钙)资源,加入的足量试剂①是___________(填化学式)。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_________(填标号字母)
A.蒸馏 B.过滤 C.萃取 D.分液
(3)加入的足量试剂②是______________________(填化学式)。
(4)写出由无水MgCl2制取金属镁的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是
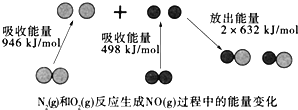
A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com