
科目: 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
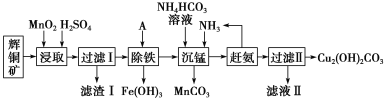
(1)“浸取”反应中氧化剂的化学式为________;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2 和________、________ (写化学式)。
(2)“除铁”这一步反应在 25 ℃ 进行,加入的试剂 A 为________,若加 A 后溶液 的 pH调为 4,溶液中 Fe3+浓度为______mol/L。{已知 Ksp[Fe(OH)3]=4.0×10-38}
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:________________________________。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是__________(写化学式)。
(5)过滤Ⅱ的沉淀经过洗涤、干燥可以得到碱式碳酸铜,如何判断沉淀已洗净?_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解一定浓度的 CuSO4 溶液一段时间后,欲使溶液恰好恢复至电解前情况, 不可能加入的物质是
A. CuSO4 B. Cu(OH)2 C. CuCO3 D. CuO
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
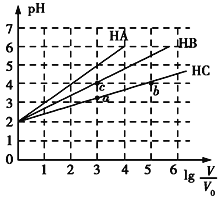
A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度,![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
元素 | 相关信息 |
X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
Y | 原子核外电子有7种不同的运动状态 |
Z | 地壳中含量最高的元素 |
W | 价电子排布式为(n+1)sn(n+1)pn+2 |
R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
(1)基态R原子的电子排布式为______________________________________。
(2)Y2分子中σ键和π键的数目比为________________。
(3)X、Y、Z三种元素的第一电离能由小到大的顺序为____________(用元素符号表示),元素Y的简单气态氢化物的沸点比元素X的简单气态氢化物沸点高的主要原因是_____________。
(4)元素Z、W组成的微粒WZ42-的空间构型是______,其中W原子的杂化轨道类型为________。
(5)已知Z、R能形成一种化合物,其晶胞结构如图所示,该化合物的化学式为________;若相邻的Z原子和R原子间的距离为a cm,设阿伏加德常数的值为NA,则该晶体的密度为__________g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是

A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
科目: 来源: 题型:
【题目】mA(g)+nB(g) ![]() pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是:( )
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是:( )
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变⑤反应速率VA:VB:VC:VD=m:n:p:q ⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
查看答案和解析>>
科目: 来源: 题型:
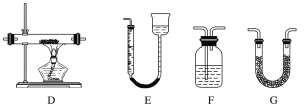
【题目】某实验研究小组欲检验草酸晶体分解的产物并测定草酸溶液的浓度(杂质不发生反应)。查阅资料:草酸晶体(H2C2O4·2H2O)在100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。下面是可供选择的实验仪器(图中某些加热、夹持装置已略去),实验所需药品不限。
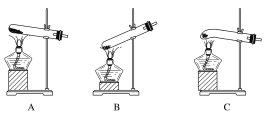
(1)最适宜加热分解草酸晶体的装置是C。若选装置A可能会造成的后果是______________;若选装置B可能会造成的后果是_________________________________。
(2)实验利用装置“G(碱石灰)—F—D(CuO固体)—F”检验CO,则F中盛装的试剂是_______,证明含有CO的现象是_____________________________________________。
(3)可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①滴定过程中发生反成的离子方程式为_________________________________________。②滴定过程中操作滴定管的图示正确的是_________。
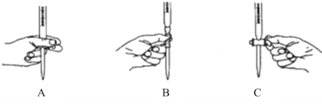
③判断反应达到滴定终点时的现象为__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学键的键能是形成(或断开)1 mol 化学键时释放(或吸收)的能量。已知白磷和 P4O6 的分 子结构如图所示:
现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O==O:498

若生成 1 mol P4O6,则反应 P4(白磷)+3O2==P4O6 中的能量变化为
A. 吸收 1638 kJ 能量 B. 放出 1638 kJ 能量
C. 吸收 126 kJ 能量 D. 放出 126 kJ 能量
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com