
科目: 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g) ===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B. 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g) ===2CO(g) ΔH=-110.5 kJ·mol-1
C. 已知:H2(g)+ ![]() O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D. 已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是
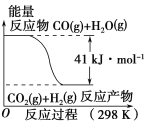
A.该反应为吸热反应
B.CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g) 要放出41 kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图2所示。则下列结论正确的是( )
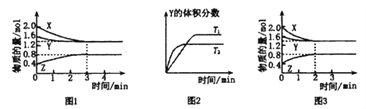
A. 容器中发生的反应可表示为:4X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应进行的前3min内,用X表示的反应速率v(X)=0.3mol/(L·min)
C. 升高温度,反应的化学平衡常数K增大
D. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组利用下图装置制取乙酸乙酯,其中A盛浓硫酸,B盛乙醇、无水醋酸,D盛饱和碳酸钠溶液。
已知:
①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②几种有机物沸点:乙醚34.7℃,乙醇78.5℃,乙酸117.9℃,乙酸乙酯77.1℃;
③乙酸与乙醇反应生成酯的过程中酸分子断裂C-O键,醇分子断裂O—H键。

请回答:
(1)乙醇分子中官能团的名称是__________________。
(2)A的名称是_____________;浓硫酸的主要作用是作____________________。
(3)在B中加入几块碎瓷片的目的是_______;C除起冷凝作用外,另一重要作用是_____。
(4)若参加反应的乙醇为CH3CH2l8OH,请写出用该乙醇制乙酸乙酯的化学方程式__________;该反应类型为___________。
(5)D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,其净化过程如下:
ⅰ:加入无水氯化钙,去除_________________;
ⅱ:最好加入________(填字母序号)作吸水剂;
A 碱石灰 B 氢氧化钾 C 无水硫酸钠
ⅲ:蒸馏,收集77℃左右的馏分,得到较纯净的乙酸乙酯。
查看答案和解析>>
科目: 来源: 题型:
【题目】认真观察下列装置,下列说法错误的是
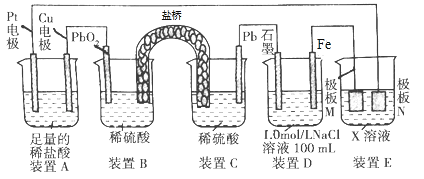
A. 装置B中PbO2上发生的电极反应方程式为PbO2+4H++SO42-+2e-=PbSO4+2H2O
B. 装置A中总反应的离子方程式为Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
C. 若在装置D中生成0.2 mol Fe(OH)3,则消耗水的物质的量共为0.5 mol
D. 若装置E的目的是在Cu材料上镀银,则极板N的材料为Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程。
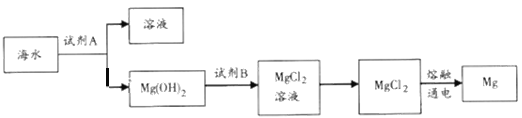
①工业上常用于沉淀Mg2+的试剂A是__________(填化学式),Mg(OH)2转化为MgCl2的离子方程式为________________________。
②由无水MgCl2制取Mg的化学方程式是______________________。
(2)海带灰中富含以I-形式存在的碘元素,实验室提取I2的途径如下所示:
![]()
①灼烧海带至灰烬时所用的主要仪器是__________(填名称);
②向酸化的滤液中加过氧化氢溶液,该反应的离子方程式为__________;
③反应结束后,加入CCl4作萃取剂,采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
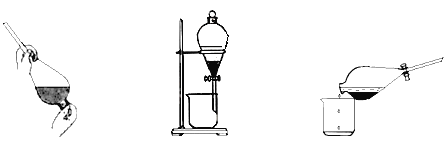
甲.加入萃取剂后振荡 乙.静置分层 丙.分离
甲、乙、丙3步实验操作中,错误的是__________(填“甲”、“乙”或“丙”)。
(3)海水中部分离子的含量如下:
成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
若从100L该海水中提取镁,理论上需加入试剂A__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) === xC(g)+2D(g);5 min后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1。
(1)A在5 min末的浓度是____________;
(2)v(B)=____________;
(3)x=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据A~E几种烃分子的结构填空。
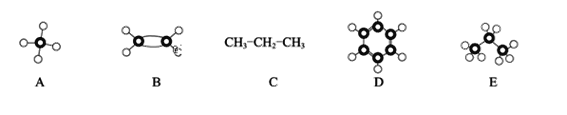
上述分子中属于C的同系物的是_____________(填字母序号)。
(2)随着工业的发展和社会的进步,人们日益关注环境问题。
①下列物质属于室内空气污染物的是__________________(填字母序号,下同);
A CO2 B 甲醛 C N2
②按照垃圾分类的方法,易拉罐瓶属于________________________;
A 可回收物 B 可堆肥垃圾
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是__________。
A 用氯气除去废水中的悬浮物 B 用中和法除去废水中的酸
C 用明矾除去废水中的重金属离子
(3)化学是材料科学发展的基础,合理使用材料有利于人类的生产和生活。
①在一定条件下,将某种单体进行加聚反应得到一种如下图所示的导电性塑料:
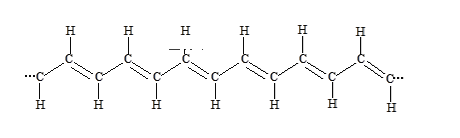
则合成该塑料的单体为___________ (填字母序号,下同);
A 乙炔 B 乙烯 C 乙烷 D 甲烷
②工业炼铁通常采用的方法是__________;
A 加热分解法 B 电解法 C 高温还原法
③某同学欲探究铁在NaCl溶液、蒸馏水和空气中锈蚀的快慢,设计了如下实验。
实验序号 | A | B | C |
实验 内容 |
|
|
|
一周后,试管中铁钉锈蚀程度最大的是__________;
④将质量相同的铁片、铜片用导线连接后浸入硫酸铜溶液中,构成原电池,工作一段时间后铜片质量与铁片质量相差12 g,则理论上导线中通过______mol电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种。在此晶体中,氧离子和过氧离子的物质的量之比为
A. 2∶1 B. 1∶2 C. 1∶1 D. 1∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
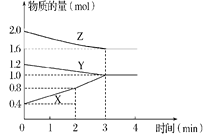
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- +SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com