
科目: 来源: 题型:
【题目】A、B、D、E、F、G是原子序数依次增大的六种短周期元素。A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15。回答下列问题:
(1)E元素在元素周期表中的位置是__________;A离子的结构示意图为____________。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为__________。
(3)①B2A2中含有___________键和_________键,其电子式为__________。
②该物质与水反应的化学方程式为_______________。
(4)下列说法正确的是__________(填字母序号)。
①B、D、E原子半径依次减小
②六种元素的最高正化合价均等于其原子的最外层电子数
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
(5)在E、F、G的最高价氧化物对应水化物中,酸性最强的为_________(填化学式),用原子结构解释原因:同周期元素电子层数相同,从左至右,_________,得电子能力逐渐增强,元素非金属性逐渐增强。
查看答案和解析>>
科目: 来源: 题型:
【题目】能用H++OH-=H2O来表示的化学反应是
A. 氢氧化镁和稀盐酸反应 B. Ba(OH)2溶液滴入稀硫酸中
C. 澄清石灰水和稀硝酸反应 D. 氢氧化钠和稀醋酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和碳一样也存在一系列氢化物如NH3、N2H4、N3H5、N4H6等。
(1)N3H5的电子式为_______。
(2)已知4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=a kJ/mol K1①;
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=b kJ/mol K2②;
写出N2与O2反应生成1 mol NO气体的热化学方式程式为________________________;
(3)已知NH3·H2O为一元弱碱,N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O+H2O![]() N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
(4)如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
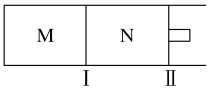
①向M、N中,各通入2 mol N2和6 mol H2。初始M、N容积相同,并保持温度不变。则到达平衡时H2的转化率α(H2)为M________N(填“>”“=”“<”)。
②若在某条件下,反应N2(g)+3H2(g)![]() 2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是( )
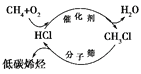
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 上图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想
D. 让煤变成水煤气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目: 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
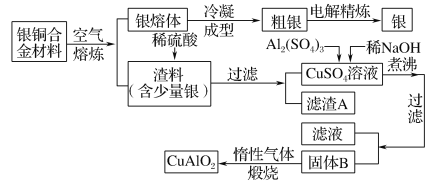
[注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃]
(1)电解精炼银时,阴极反应式为___________________________。
滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________________。
(2)固体混合物B的组成为________;
(3)完成煅烧过程中一个反应的化学方程式:__
________CuO+________Al2O3![]() ________CuAlO2+________。
________CuAlO2+________。
(4)CuSO4溶液也可用于制备胆矾,其基本操作是____________、过滤、洗涤和干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2),黄绿色易溶于水的气体,是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为_____.
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
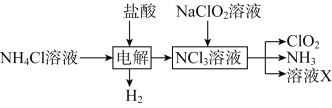
①电解时发生反应的化学方程式为_______________________________。
②除去ClO2中的NH3可选用的试剂是________(填标号)。
a.水 b.碱石灰
c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
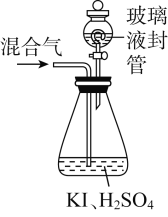
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-===2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为________________。
②测得混合气中ClO2的质量为__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
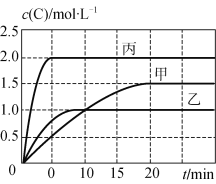
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com