
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3 + SO2 = Na2S2O5。
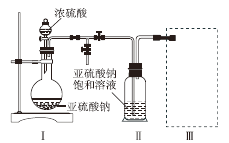
⑴ 装置Ⅰ中产生气体的化学方程式为________________________________;
⑵ 上图中盛装浓硫酸的玻璃仪器的名称是:__________________________;
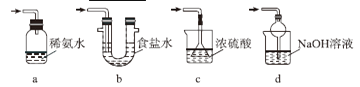
⑶ 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
实验二 焦亚硫酸钠的性质(Na2S2O5溶于水即生成NaHSO3)
⑷ 证明NaHSO3溶液中HSO![]() 的电离程度大于水解程度,可采用的实验方法是___________(填序号)。
的电离程度大于水解程度,可采用的实验方法是___________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
实验三 葡萄酒中抗氧化剂残留量的测定
⑸ 葡萄酒常用Na2S2O5作抗氧化剂。测定葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(滴定时反应为SO2 + I2 + 2H2O = H2SO4 + 2HI)

①上述滴定过程中的终点现象为______________________________________;
②按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________g·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】将3molA气体和1.5molB气体在3L的容器中混合并在一定条件发生如下反应: 2A(g)+B(g) ![]() 2C(g)。经2s后测得C的浓度为0.3mol/L,则下列计算正确的是:
2C(g)。经2s后测得C的浓度为0.3mol/L,则下列计算正确的是:
①用A表示的平均反应速率为0.3mol/(L·s)
②2s时物质A的浓度为0.7mol/L
③用B表示的平均反应速率为0.15mol/(L·s)
④2s时物质B的转化率为30%
A. ②④B. ①④C. ②③D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】现有 0.175 mol·L-1醋酸钠溶液500 mL,(已知室温下,醋酸的电离平衡常数Ka=1.75×10-5)。
⑴ 写出醋酸钠水解反应的化学方程式______________________________;
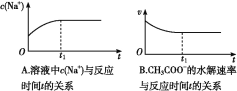
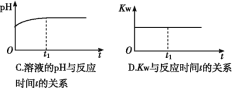
⑵ (双选)下列图象能说明醋酸钠的水解反应达到平衡的是____________;
⑶ (双选)向醋酸钠溶液中加入少量下列物质,水解平衡向正向移动的有______;
A.冰醋酸 B.纯碱固体 C.醋酸钠固体 D.氯化铵固体
⑷ (双选)在醋酸钠溶液中加入冰醋酸,溶液中微粒浓度的关系式能成立的有__________;
A.c(CH3COO-) + c(CH3COOH) > c(Na+)
B.c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
C.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.c(CH3COO-) > c(H+) > c(OH-) > c(Na+)
⑸ 欲配制0.175 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案:
方案一:用托盘天平称取___________g无水醋酸钠,溶于适量水中,配成500 mL溶液。[已知:M(CH3COONa) = 82g/mol ]
方案二:用体积均为250 mL且浓度均为___________mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
⑹ 在室温下,0.175 mol·L-1醋酸钠(CH3COONa)溶液的pH约为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(g) ![]() xC(g) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是
xC(g) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是

A. ΔH>0,m+n>x
B. ΔH<0,m+n>x
C. ΔH>0,m+n<x
D. ΔH<0,m+n<x
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~⑨在表中的位置,按要求回答下列问题:
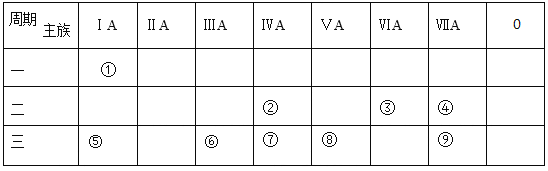
(1)在元素①~⑨,最活泼的金属元素是______(填元素名称);最活泼的非金属元素名称是______(填元素名称)
(2)用电子式表示元素③与⑤形成的原子个数比为1∶2的化合物 ______。元素①和③所形成的化学键的类型是_______。
(3)②、⑤、⑦三种元素的原子半径由大到小的顺序是______(用元素符号表示)。
(4)元素④和⑨所能形成的气态氢化物的稳定性______(用化学式表示);元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序______(用化学式表示);
(5)写出元素![]() 和
和![]() 的最高价氧化物的水化物相互反应的离子方程式:______。
的最高价氧化物的水化物相互反应的离子方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g) + nB(g) ![]() pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
②体系温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
⑦体系的密度不再变化
A.③④⑤⑥ B.②③④⑥
C.①③④⑤ D.③④⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如下(夹持仪器已略去)。请回答以下问题。
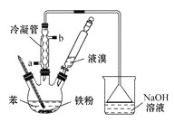
(1)制取溴苯的化学方程式是 ___________,反应过程中烧瓶内有白雾产生,是因为生成了________气体。
(2)该实验中用到冷凝管,由此猜想生成溴苯的反应属于________反应(填“放热”或“吸热”);使用冷凝管时,进水口应是______(填“a”或“b”)。
(3)该实验中将液溴全部加入苯中,充分反应后,为提纯溴苯,进行以下操作:
①将烧瓶中的液体倒入烧杯中,然后向烧杯中加入少量水,过滤,除去未反应的铁屑,过滤时必须用到的玻璃仪器是烧杯、玻璃棒、____________。
②滤液再经一系列处理,最终得到的粗溴苯中仍含有少量苯,要进一步提纯溴苯,可进行的操作是_____(填字母)。
物质 | 苯 | 溴苯 |
沸点/℃ | 80 | 156 |
水中溶解性 | 微溶 | 微溶 |
a.洗涤 b.过滤 c.蒸馏 d.结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
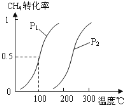
⑴①将1.0 mol CH4和2.0 mol H2O(g)通入容积100L的反应室,一定条件下发生反应:CH4(g) + H2O(g) CO(g) + 3H2(g)
Ⅰ,CH4的转化率与温度、压强的关系如图。已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为:_____________;
②图中的压强P1_________P2(填“大于”、“小于”或“等于”),100℃时的平衡常数为:_______;
③在其它条件不变的情况下降低温度,逆反应速率将__________(填“增大”、“减小”或“不变”)。
⑵在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g) + 2H2(g) CH3OH(g)
Ⅱ。①若容器容积不变,下列措施可提高甲醇产率的是:________________;
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.加入更高效的催化剂
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中,请帮他完成该表。
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
A | 150 | 1/3 | 0.1 |
B | Ⅰ | Ⅱ | 5 |
C | 350 | 1/3 | Ⅲ |
表中Ⅰ、Ⅱ、Ⅲ分别为:__________、____________、____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,且四种元素分别位于不同的主族,它们的单质常温下均呈气态。X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X2+Y2→甲,X2+W2→乙,已知,甲、乙常温下均为气态,且两者在空气中相遇时可化合成丙。试回答下列问题:
⑴ Y和Z对应的氢化物比较稳定的是:_______________。(填化学式)
⑵ 化合物丙属于_____________晶体(填晶体类型),其水溶液显酸性,用离子方程式表示其原因:_________________________________________。
⑶ X、Z可组成四原子化合物丁,丁中所含的化学键类型为:____________键,请说出化合物丁的一种常见用途:___________________________________ ;
⑷ X、Y组成的液态化合物Y2X4 16 g与足量丁反应生成Y2和液态水,放出QkJ的热量,写出该反应的热化学方程式:______________________________;
Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为:________________________________________ 。
⑸ 一定条件下,取 3.4 g甲气体置于1 L恒容的容器中,4分钟后,容器内的压强变为原来的1.2倍,且不再变化,该反应中甲气体的转化率为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com