
科目: 来源: 题型:
【题目】硫化氢分解制取氢气和硫磺的原理为2H2S(g)![]() S2(g)+ 2H2(g),在2.0L恒容密闭容器中充入0.1mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法正确的是
S2(g)+ 2H2(g),在2.0L恒容密闭容器中充入0.1mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法正确的是

A. 正反应是放热反应
B. 图中P点:v(正)> v(逆)
C. 950℃时,0~1.25s内,生成H2 的 平均反应速率为0.016 mol·l-1 ·s-1
D. 950℃时,该反应的平衡常数的值小于3.125×10-4
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:

(1)这些元素中,化学性质最不活泼原子的原子结构示意图为______;气态氢化物中,最稳定的是______;最高价氧化物对应水化物中,酸性最强的是_______。
(2)①和④两种元素的原子按1:1组成的常见化合物的电子式为______。
(3)②、③的单质中更容易与①的单质反应的是________(用化学式表示)。
(4)④、⑦、⑧、⑨的简单离子半径由大到小的顺序为_____(用离子符号和“>”表示)。
(5)⑥和⑧的最高价氧化物对应水化物之间发生反应的离子方程式____________。
(6)⑤⑨三种元素的单质沸点由高到低的顺序是_____(用化学式和“>”表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | 硫 酸 | 纯 碱 | 熟石灰 | 铁 红 |
B | 氢硫酸 | 烧 碱 | 纯 碱 | 生石灰 |
C | 碳 酸 | 苏打 | 小苏打 | 二氧化硫 |
D | 二氧化碳 | 苛性钠 | 食 盐 | 石灰石 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O ![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑥反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
A. ①④ B. ②③ C. ②⑥ D. ②③⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
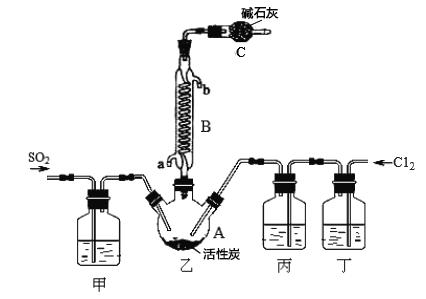
(1)从下表中选择相应的装置完成填空:
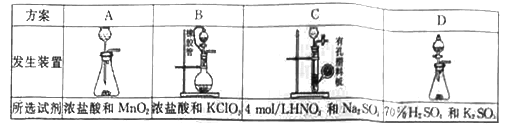
①制备SO2选________(填字母)。
②写出用所选装置制取Cl2的离子方程式_________________。
(2)合成SO2C12的装置图中仪器B的名称为_________________;丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)为提高本实验中的产率,在实验操作中还需要注意的事项有(只答—条即可)__________。
(6)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com