
科目: 来源: 题型:
【题目】镁及其合金是一种用途广泛的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)镁在元素周期表中位于第__________周期,第___________族。
(2)为使MgSO4完全转化为Mg(OH)2沉淀,试剂①可选用____________(填化学式),且加入试剂①的量应______________(选填“少量”或“过量”)。
(3)若要检验溶液A中含有的SO42-,使用的试剂是_________________。
(4)加入试剂①后,分离得到Mg(OH)2沉淀的方法是__________。试剂②可以选用_______。
(5)反应①、反应②、反应③属于氧化还原反应类型的是________。
(6)工业上常用电解熔融MgCl2的方法冶炼得到金属Mg,写出该反应的化学方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:
CO+H2O![]() CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
A. 等于0.6mol B. 等于1mol
C. 大于0.6mol且小于1mol D. 大于1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下[已知N2(g)十3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol];下列说法正确的是( )
2NH3(g) △H=-92.4kJ/mol];下列说法正确的是( )
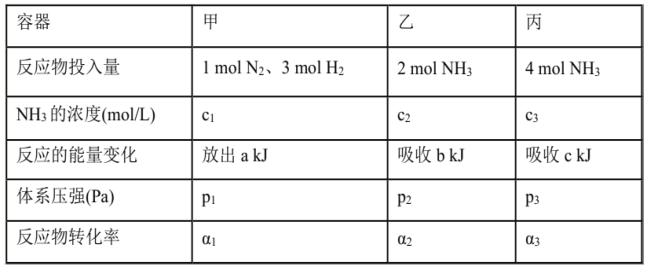
A. 2c1>c3 B. a+b>92.4 C. 2p2<p3 D. α1+α3<1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.镀铜铁制品镀层破坏后,铁制品更易发生腐蚀
B.使用催化剂既能改变反应速率,又能改变焓变
C.其他条件不变时,升高温度,吸热反应的v正增大,v逆减小
D.工业电解精炼铜时,粗铜与电源的负极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。
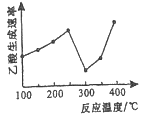
①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
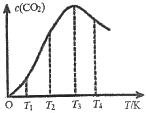
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
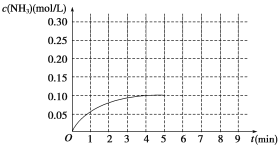
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,请用化学用语填空回答以下问题:
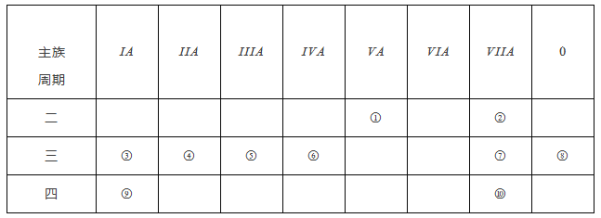
(1)化学性质最不活泼的元素原子的原子结构示意图为________。
(2)元素①、②的简单氢化物的稳定性更强的是______________(用化学式表示,下同)。
(3)元素的最高价氧化物对应的水化物中酸性最强的是______,碱性最强的是____,呈两性的氢氧化物是_________,元素③的最高价氧化物对应水化物中含有的化学键类型为________。
(4)在③~⑦元素中,简单离子半径最小的是_________。
(5)元素③的过氧化物的电子式为_________。
(6)在⑦与⑩的单质中,氧化性较强的是_____,用化学反应方程式证明:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式____________
已知: CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式________________________ 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。

(4)以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。
②为了提高该反应中CH4的转化率,可以采取的措施是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下为工业从海水中提取液溴的流程图:
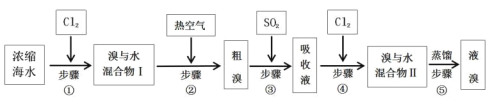
(1)当进行步骤①时,应关闭活塞_______,打开活塞____________。
已知:溴的沸点为 59 ℃,微溶于水,有毒性。某同学利用下图装置进行步骤①至步骤④的实验,请回答:
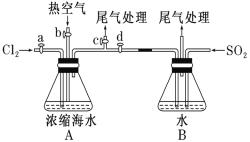
(2)步骤②中可根据_____________现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是_____________。
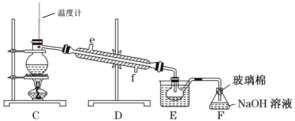
(4)步骤⑤用下图装置进行蒸馏。装置 C 中直接加热不合理,应改为______,蒸馏时冷凝水应从______端进入(填“e”或“f”), F 的作用是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是苯和溴的取代反应的实验装置图,其中 A 为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉。填写下列空白:

(1)向反应容器A 中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A 中发生反应的化学方程式(有机物写结构简式)____;
(2)能证明A 中发生的是取代反应,而不是加成反应,试管C 中苯的作用是__________。反应开始后,观察D 和E 两支试管,看到的现象分别是___________,________;
(3)反应 2 min~3 min 后,在 B 中的氢氧化钠溶液里可观察到的现象是______、_____;
(4)苯是一种重要的化工原料,以下是用苯作为原料制备某些化合物的转化关系图:

已知:a.RNO2 ![]() RNH2
RNH2
b.苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
c.![]() +H2SO4(浓)
+H2SO4(浓)![]()
 +H2O
+H2O
①A 转化为 B 的化学方程式是________;
②E 的结构简式为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com