
科目: 来源: 题型:
【题目】等质量且足量的两份锌a、b,分别加入等量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列各图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
A. 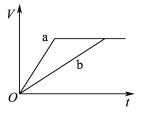 B.
B. 
C. 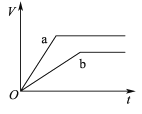 D.
D. 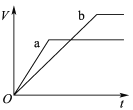
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是______________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。
已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式_____________________。
Ⅲ、某温度时测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数KW =_________
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是________mL。

(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL
B.是(50-a)mL
C. 一定大于amL
D.一定大于(50-a)mL
查看答案和解析>>
科目: 来源: 题型:
【题目】关于如图所示装置的叙述,错误的是( )

A. 锌是负极,其质量逐渐减小B. 氢离子在铜表面被还原,产生气泡
C. 电子从锌片经硫酸溶液流向铜片D. 电子从锌片经导线流向铜片
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸是一种常见的弱酸,在0.1mol·L﹣1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:(填“正向”、“逆向”或“不移动”, “增大”、“减小”或“不变”, 填“>”、“<”或“=”)
(1)向醋酸中加入醋酸钠固体,电离平衡向___________移动;pH __________
(2)向醋酸中加入碳酸钙固体,电离平衡向________移动;c(CH3COOH)_________.
(3)向醋酸中加入大量的水,c(OH-)_________.导电能力__________.
(4)体积相同、物质的量浓度均为0.1 mol·L-1的①盐酸、②醋酸两种溶液,pH:①_____②;与完全相同的镁条发生反应,开始时的反应速率:①______ ②;中和等量NaOH时消耗的体积:①______②;与足量的Zn反应生成H2的物质的量:①_______②。
查看答案和解析>>
科目: 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:

下列有关说法正确的是
A. “灼烧”时,可在玻璃坩埚中进行
B. “浸取”时,可用无水乙醇代替水
C. “转化”反应中,生成的KMnO4与MnO2的物质的量之比为1:2
D. “浓缩结晶”后的母液中可能含有KMnO4和K2CO3两种溶质
查看答案和解析>>
科目: 来源: 题型:
【题目】在某温度下,冰醋酸(纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:
(1)起点导电能力为0的理由是__________________.
(2)用湿润的pH试纸测量a处溶液的pH,测量结果______(偏大、偏小或不变)
(3)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)

①pH:________;
②醋酸的电离程度:_________;
③醋酸的电离平衡常数:____________;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:______.
(4)若使c点溶液中c(CH3COO﹣)增大,c(H+)减小,可采用的措施有(答二类不同的物质):①_________,②__________.
(5)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是______.
A.c(H+) B.H+个数 C.CH3COOH个数 D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-5 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
请回答下列问题:
(1)25 ℃时,在某二元酸 H2A 溶液中存在的所有微粒为:H+、OH-、HA-、A2-、H2O,写出 H2A 的 电离方程式_____。
(2)25 ℃时,在 0.5 mol·L-1 的醋酸溶液中由醋酸电离出的[H+]约是_________,是该溶液 中由水电离出的[H+]的_____倍,醋酸的电离度为_____(填百分数)
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______________________________。
(4)25 ℃时,CH3COOH 与 CH3COONa 的混合溶液,若测得混合液 pH=6,则溶液中[CH3COO-]-[Na+]=_____(填准确数值)。
(5)25 ℃时,将 a mol·L-1 的醋酸与 b mol·L-1 氢氧化钠溶液等体积混合,反应后溶液恰好显中性, 用 a、b 表示醋酸的电离常数为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某矿样中含有大量的 CuS 及少量其他不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O 晶体,流程如下:
![]()
(1)在实验室中,欲用 37%(密度为 1.19 g·mL-1)的盐酸配制 500 mL 6 mol·L-1 的盐酸,需要的仪器除 量筒、烧杯、玻璃棒外,还有_____、_____。
(2)①若在实验室中完成系列操作 a。则下列实验操作中,不需要的是____________(填字母)。

②CuCl2 溶液中存在平衡:Cu(H2O)42+(蓝色)+4Cl-![]() CuCl42-(黄色)+4H2O。欲用实验证明滤液 A(绿色)中存在上述平衡,除滤液 A 外,下列试剂中还需要的是_____(填字 母)。
CuCl42-(黄色)+4H2O。欲用实验证明滤液 A(绿色)中存在上述平衡,除滤液 A 外,下列试剂中还需要的是_____(填字 母)。
a.FeCl3 固体 b.CuCl2 固体 c.蒸馏水
(3)某化学小组欲在实验室中研究 CuS 焙烧的反应过程,查阅资料得知在空气中焙烧 CuS 时,固体 质量变化曲线及 SO2 生成曲线如图。

①CuS 矿样在焙烧过程中,有 Cu2S、CuO·CuSO4、CuSO4、CuO 生成,转化顺序为CuS![]() Cu2S
Cu2S![]() CuO·CuSO4
CuO·CuSO4![]() CuSO4
CuSO4![]() CuO第 ① 步 转 化 主 要 在 200 ~ 300 ℃ 内 进 行 , 该 步 转 化 的 化 学 方 程 式______。
CuO第 ① 步 转 化 主 要 在 200 ~ 300 ℃ 内 进 行 , 该 步 转 化 的 化 学 方 程 式______。
②300~400 ℃内,固体质量明显增加的原因是_____,图所示过程中,CuSO4固体能稳定存在的阶段是____________(填字母)。
a.一阶段 b.二阶段 c.三阶段 d.四阶段
③该化学小组设计如下装置模拟 CuS 矿样在氧气中焙烧第四阶段的过程,并验证所得气体为 SO2和 O2 的混合物。

a.装置组装完成后,应立即进行的一项操作是_____。
b.当 D 中产生白色沉淀时,说明第四阶段所得气体为 SO2 和 O2 的混合物,你认为 D 中原来盛有________溶液。
c.若原 CuS 矿样的质量为 10.0 g,实验过程中,保持在 760 ℃左右持续加热,待矿样充分反应后, 石英玻璃管内所得固体的质量为 8.0 g,则原矿样中 CuS 的质量分数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com