
科目: 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)烧杯间填满碎纸条的作用是____________________。
(2)大烧杯上如不盖硬纸板,求得的中和热的数值_________(填“偏大”“偏小”“无影响”)。
(3)从实验装置上看,图中如果没有环形玻璃搅拌棒搅拌,如此求得的中和热的数值_________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________________(填“相等”“不相等”),所求中和热____________(填“相等”“不相等”),简述理由:_______________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______________;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会_____________________。(均填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
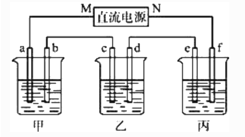
接通电源,经过一段时间后,测得丙中K2SO4的质量分数变为10.47%,乙中c电极质量增加。
①电源的N端为________极;
②电极b上发生的电极反应式为___________________________________________;
③电极b上生成的气体在标准状况下的体积___________L;
④电极c的质量变化是________g;
⑤电解前后溶液的pH保持不变的是________。
A.甲溶液 B.乙溶液 C.丙溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)请将 Zn+2Ag+=2Ag+Zn2+设计成双液原电池,并画出简易装置图,并注明电极材料以及电解质溶液_______________
(2)书写HCHO﹣空气燃料电池(电解质为熔融碳酸盐)的负极电极反应式___________________________________________。
(3)氯-铝电池是一种新型的燃料电池,电解质溶液是KOH溶液,请写出电子流出的电极的电极反应式为:______________________________________。
(4)已知:
Fe(s)+1/2O2(g)=FeO(s) △H=-272.0kJ/mol
2Al(s)+3/2O2(g)= Al2O3(s) △H=-1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是_____________________________________________________。
(5)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444kJ,试写出氢气燃烧生成液态水的热化学方程式__________________________________________________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是____________________。
(2)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为____________________。
②部分化学键键能数据如下:

△H2=__________kJ·mol-1
(3)1573K时,N2+O2![]() 2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(4)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1.68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是____________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要____________________。
(5)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A.反应速率与NO浓度有关 B.反应速率与NO2浓度有关
C.反应的中间产物只有NO3 D.第二步反应活化能较高
查看答案和解析>>
科目: 来源: 题型:
【题目】将AsO43-+2I-+2H+ ![]() AsO33-+I2+H2O设计成图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
AsO33-+I2+H2O设计成图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
甲组:向B烧杯中逐滴加入浓盐酸
乙组:向B烧杯中逐置滴加入40%NaOH溶液,下列描述中,正确的是

A. 甲组操作过程中,C2做负极
B. 乙组操作过程中,C1上发生的电极反应为: 2I—-2e—=I2
C. 两次操作过程中,微安表(G)指针的偏转方向相反
D. 甲组操作时该装置为原电池,乙组操作时该装置为电解池
查看答案和解析>>
科目: 来源: 题型:
【题目】利用银镜反应给玻璃镀上一层银是化学镀的一种,某化学兴趣小组设计的给ABS工程塑料零件先化学镀,后电镀的工艺流程如下,回答下列问题:

(1)塑料零件不能直接进行电镀的原因是____________________,Na2CO3溶液可用于除去塑料零件表面的油污,理由是____________________(用离子方程式表示)。
(2)粗化是利用粗化液与塑料表面的高分子化合物反应,使塑料表面粗糙不平;粗化液的主要成分CrO3(铬酐),由重铬酸钠与浓硫酸加热熔融反应、再分离除去硫酸氢钠制得,写出该反应的化学方程式____________________。
(3)经粗化的塑料表面浸渍过敏化剂氯化亚锡溶液,表面吸附一层易于氧化的Sn2+离子。用氯化亚锡晶体(SnCl2·2H2O)配制氯化亚锡溶液时,还需要的试剂有____________________。
(4)活化是将经过敏化处理的塑料与硝酸银溶液反应,在塑料表面吸附一层具有催化活性的金属微粒,写出生成有催化活性的金属微粒的离子方程式____________________。
(5)将经活化处理的塑料置于含有Cu(OH)2、HCHO、NaOH的化学镀铜液中一段时间,可以在塑料表面镀上一层厚度为0.05-0.2μm的金属导电薄层,同时生成HCOONa和H2,若两种还原产物的物质的量相等,写出该反应的化学方程式____________________。
(6)塑料经化学镀的镀层厚度不能满足产品的防腐、耐磨等方面的要求,必须采用电镀镀到所需的厚度,电镀时,有金属导电薄层的塑料作电镀池的_____极,维持电流强度为1.5A,电镀5分钟,理论上塑料表面析出铜__________g。(已知F=96500C·mol-1)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用下列装置制取氨气并探究氨气的有关性质。

(1)图一是实验室制取氨气的发生装置,试管中反应的化学方程式为_______________。
(2)图二可用于实验室快速制取氨气,A中烧瓶内试剂可选用________(填序号,下同)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷
(3)为探究氨气的溶解性,先利用图三装置收集氨气,氨气的进气口为_____(填“a”或“b”),在实验过程中观察到图三中的烧瓶内产生了红色喷泉,则说明氨气具有的物理性质是___。
(4)通过上面装置制得的NH3进行如下实验(实验前旋塞1、2均关闭)。

①先打开旋塞1,D瓶中的现象是_____________,原因是_______________(用化学方程式表示);
②稳定后,关闭旋塞1,再打开旋塞2,观察到的现象是___________________。
(5)为防止环境污染,以下装置(除⑤标明外,其余盛放的液体均为水)可用于吸收多余氨气的是____________(填序号)。

查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:

(1)NaClO2中Cl的化合价为________。
(2)写出“反应”步骤中生成ClO2的化学方程式并配平:_____________。
(3)已知“尾气吸收”反应的化学方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O。
此反应中还原剂是________,若产生8gO2,则该反应转移电子数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________、__________。
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是__________。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________。
③C的作用是__________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________。
②滴定结果如下表所示
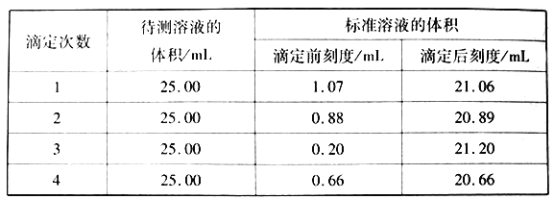
该样品中氮的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素的原子序数依次增大,B的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的原子结构示意图为: ,D的最外层电子数是电子层数的2倍。试回答下列各问题:
,D的最外层电子数是电子层数的2倍。试回答下列各问题:
(1)A的阴离子的结构示意图为_____________;
(2)C元素位于元素周期表中第________周期、第_______族;
(3)化合物B2A的电子式为______________;
(4)已知:D的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com