
科目: 来源: 题型:
【题目】2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式_______________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) 时间(min) | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量 B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②在T0C时,该反应的平衡常数为______________(小数点后保留两位有效数字);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为______________
②下列关于该电池的说法正确的是(_____)
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B. pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
C. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) >c(H+)
D. 向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/ c(NH3·H2O)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】a、b、c、d四种元素在周期表中的位置如下图,则下列说法正确的是

A. a与b之间容易形成离子化合物
B. 若b的单质可作半导体材料,则c的单质不可能为半导体材料
C. 若b的单质与H2易化合,则c的单质与H2更易化合
D. 若b的最高价氧化物对应水化物为H2bO4,则a的氢化物的化学式为aH3
查看答案和解析>>
科目: 来源: 题型:
【题目】I、白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3 则ΔH3=__
II.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液和足量的AgNO3溶液,电极均为石墨电极。接通电源,经过一段时间后,乙中c电极质量增加了32g。据此回答问题:

(1)电源的N端为________极;
(2)电极b上发生的电极反应为________________;
(3)列式计算电极b上生成的气体在标准状况下的体积:________L;
(4)丙池中______(e或f)电极析出金属Ag__________g;
(5)电解前后各溶液的pH是否发生变化(填增大、或减小 、或不变):
甲溶液________________;乙溶液________________;丙溶液________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】某烷烃相对分子质量为86,若该分子中仅含有3个甲基(—CH3),则其一氯取代物最多有( )种(不考虑立体异构)
A. 7 B. 8 C. 9 D. 10
查看答案和解析>>
科目: 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )
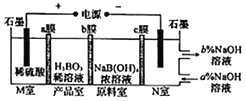
A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3·BH3)作为一种非常有前景的储氢材料,近年来日益受到人们的重视。氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图所示。该电池的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是( )

A. 右侧电极发生氧化反应 B. 电池工作时,H+通过质子交换膜向左侧移动
C. 负极的电极反应式为H2O2+2H++2e-=2H2O D. 每消耗31g氨硼烷,理论上应转移6mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 利用丁达尔现象可以鉴别胶体和溶液
B. 氯化铁用于止血与胶体的聚沉有关
C. 氢氧化铁胶体通直流电,阴极区颜色加深
D. KCl溶液、水和淀粉溶液都属于分散系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com