
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
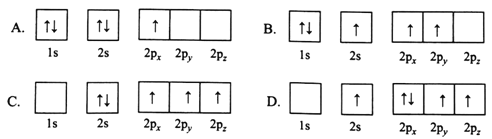
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:
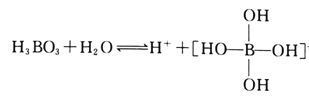
则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。
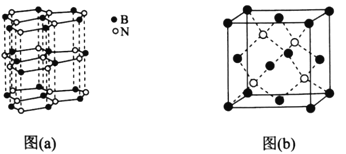
①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】人们发现金星大气层有一种称之为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列推测不正确的是( )
A. COS是含有极性键的共价化合物B. COS的沸点比CO2高
C. COS 电子式为![]() D. COS中所有原子满足8电子稳定结构
D. COS中所有原子满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA
B.4.48L氨气分子中含0.6NA个N-H键
C.铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.4℃时,20g2H216O中含有共用电子对数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。

②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。

阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图中的实验,能达到实验目的的是( )
A.  证明稳定性:Na2CO3>NaHCO3
证明稳定性:Na2CO3>NaHCO3
B.  证明非金属性:Cl>Br>I
证明非金属性:Cl>Br>I
C.  验证镁和盐酸反应的热效应
验证镁和盐酸反应的热效应
D. 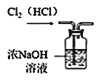 除去 Cl2 中的杂质气体 HCl
除去 Cl2 中的杂质气体 HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。图是海水综合利用的部分流程图,据图回答问题:

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ________________________。
(2)结合题目信息,写出电解饱和食盐水的化学反应方程式为 ___________________________ 。
(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换 ,SO2的作用是______,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为 _____________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出.该反应的离子方程式是 __________________________________ ;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,混合溶液用 __________ 分离。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨基甲酸铵(H2 NCOONH4)是一种白色晶体,是常见的实验药品,可由干燥的NH3和干燥的CO2在任何比例下反应得到每生成1.0g氨基甲酸铵放出2.05kJ的热量。回答下列问题:
(1)实验室可选用下列装置(I~V)制备干燥的NH3和CO2。
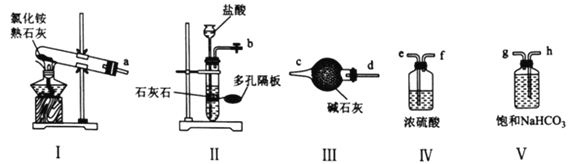
①用装置I、Ⅲ制备并纯化NH3时,接口a与________________(填接口字母)相连,装置I中发生反应的化学方程式为________________________。
②制备并纯化CO2时,按气流从左至右的方向,各接口连接顺序为________________(填接口字母)
(2)一种制备氨基甲酸铵的改进实验装置如下图所示:
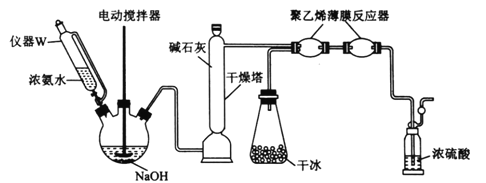
①用仪器W代替分液漏斗的优点是________________________;用干冰装置代替(1)中制备并纯化CO2装置的优点是________________________。
②“薄膜反应器”中发生反应的热化学方程式为________________________;盛浓硫酸的装置的作用是________________________________(列举2点)。
③体系中若有水蒸气,还可能生成的铵盐是________________________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符的是:( )

A. 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示加入催化剂对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
C. 图3表示H2与O2发生反应过程中的能量变化,则氢气的燃烧热为241.8kJ·mo1ˉ1
D. 图4表示用水稀释等体积且pH相同的盐酸和醋酸,溶液导电性:a>b>c
查看答案和解析>>
科目: 来源: 题型:
【题目】一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是

A. 中间室Cl—移向左室 B. 处理后的含硝酸根废水pH降低
C. X气体为CO2 D. 电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50molL-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;②用另一量筒量取50mL0.55molL-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是 ______ (填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H= ______ (结果保留一位小数)。
(3) ______(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com