
科目: 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是

A. 图甲中(1)、(2)两个实验中H2O2分解的△H相同
B. 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率
C. 图甲实验可通过观察产生气泡的快慢来比较反应速率
D. 图乙中,测定反应速率的装置可将分液漏斗用长颈漏斗替代 ,其测定结果相同
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ(1)图是等质量的Na2CO3、NaHCO3粉末分别与足量的盐酸发生反应时的情景,产生CO2气体的体积较多的试管中加入的固体试剂是_______________,当反应结束时,A、B两试管中消耗的盐酸中HCl的质量之比为______________。


(2)实验过程中我们还能感受到Na2CO3与盐酸反应时是放热反应,而NaHCO3与盐酸反应时表现为吸热。在A、B两试管的反应过程中,反应体系的能量变化的总趋势A对应于右下图____________。(填“m”或“n”)
(3) 在火箭点火时,肼(N2H4)与四氧化二氮发生反应,产生两种广泛存在的无毒无害的物质,写出该反应的化学方程式 _____________________________________________。
Ⅱ某种燃料电池的工作原理示意图如图所示,a、b均为惰性电极。

(1)使用时,空气从________(填“A”或“B”)口通入。
(2)假设使用的“燃料”是甲醇(CH3OH),总反应式为2CH3OH+4OH-+3O2= 2CO32-+6H2O,则A口加入的物质为______________(填名称)。
(3)a极反应式为_________________________________________________。
(4)当电路中通过0.3 mol电子时,消耗甲醇的质量为_____________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.冰熔化时,分子中H-O键发生断裂
B.随着相对分子质量的增加,四卤化碳CX4分子间作用力逐渐增大,所以它们相应的沸点也逐渐增高
C.由于H—O键比H—S键牢固,所以水的沸点比H2S高
D.在由分子所构成的物质中,分子间作用力越大,该物质越稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香烃的分子式为C10H14,它不能使溴水褪色,可使酸性KMnO4溶液褪色,分子结构中只含有一个侧链,符合条件的烃有( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+5HCl,发生的副反应为:C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:

(1)装置A中发生反应的离子方程式为________________________________________。
(2)仪器b的名称是__________________,其作用是____________________________。
(3)若撤去装置B,对实验的影响是______________________________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是______________________。
(5)测定产品的纯度:
①称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L碘标准溶液,再加入适量碱液,充反应: CCl3CHO +OH-→CHCl3+HCOO-,HCOO-+I2=H++2I-+CO2↑;
②再加适量盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点,发生反应: I2+2S2O32-=2I-+S4O62-;
③重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。
滴定时所用指示剂是_____________________,达到滴定终点的现象是_____________,测得产品的纯度为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= —24.8 kJ·mol-1;3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ·mol-1 ;Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +19.4kJ·mol-1则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为
A. 放出11 kJ B. 放出5.5kJ C. 吸收11 kJ D. 吸收5.5 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCl26H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:
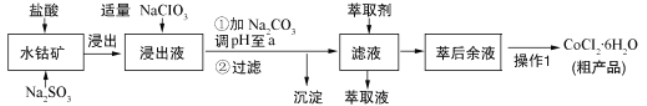
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为________________________。
(2)向浸出液中加入适量NaClO3目的是______________________________________。
(3)“加Na2CO3调pH至a”,a=______;过滤所得沉淀的主要成分为_________(填化学式)。
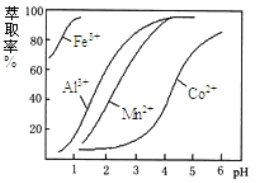
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是__________,使用该萃取剂的最佳pH范围是_____(填选项字母)
A. 5.0﹣5.5 B. 4.0﹣4.5 C. 3.0﹣3.5 D. 2.0﹣2.5
(5)实验操作“操作1”为_______________、_________、过滤和减压烘干;制得的CoCl26H2O在烘干时需减压烘干的原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.

④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置______________________________________________
(2)F元素的最高价氧化物对应的水化物的化学式为___________________________________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________________________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:__________________________________________________。
C、D还可形成化合物D2C2,D2C2中含有的化学键是_________________________________________。
(5)C、E的氢化物,沸点由高到低顺序是:_______________________________。
(6)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式,并用单线桥标明电子的转移方向_______________。当转移电子为0.2mol时,标准状况下反应产生气体_______________L。
(7)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要吸收能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com