
科目: 来源: 题型:
【题目】利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:

(1)写出该反应的平衡常数表达式为__________________.
(2)上述合成甲醇的反应为________反应(填“放热”或“吸热”). A、B、C三点的平衡常数KA、KB、KC的大小关系为____________.A、B两点对应的压强大小关系是PA________PB(填“大于”、“小于”或“等于”).
(3)若反应达到平衡状态A时,保持容器体积及体系温度不变,再向容器中充入2mol CO(g)、4molH2(g)、 2molCH3OH(g)则平衡向______方向移动(填“正”或“逆”)
(4)通常状况下取一定量的甲醇充分完全燃烧生成27克的水,放出热量544.35KJ,请写出表示甲醇燃烧热的热化学反应方程式_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C←=O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
已知ΔH2=-58 kJ·mol-1,由此计算ΔH3=________kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是___________________________________________________。
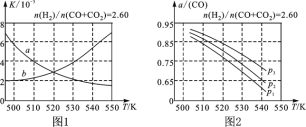
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是______________________________________________________。图2中的压强由大到小为__________,其判断理由是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年中国科学家合成了一种高能量密度材料,该成果发表在《Nature》上,合成该材料所需主要原料为草酰二肼(结构如图)。下列有关草酰二肼的说法不正确的是

A. 具有碱性
B. 完全水解可得3种化合物
C. 含有的官能团也存在于蛋白质分子中
D. 与联二脲( )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:



已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
回答下列问题:实验室可利用如图装置完成流程①和②
(1)写出工业上制取 Cl2 的化学方程式_____;恒压滴液漏斗支管的作用_____,两水槽中的水为__________(填“热水”或“冷水”).
(2)反应一段时间后,停止通氯气,再往仪器 a 中加入浓 KOH 溶液的目的是_____;
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液 I 中过量的Cl2继续反应,生成更多的KClO
D.KOH 固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:_________________。
(4)用重结晶法提纯粗产品:将粗产品先用 KOH 稀溶液溶解,再加入饱和的 KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是_____________。
②如何判断 K2FeO4 晶体已经洗涤干净________________。
(5)从环境保护的角度看,制备 K2FeO4 较好的方法为电解法,其装置如图电解过程中阳极的电极反应式为___________。
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是______________。

A.不论溶液的酸碱性如何变化,铁元素都有 4 种存在形态
B.向 pH=10的这种溶液中加硫酸至 pH=2,HFeO4-的分布分数逐渐 增大
C.向 pH=6 的这种溶液中加 KOH 溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种元素,原子序数依次增大,A是周期表中原子半径最小的元素,B原子的最外层上有4个电子;D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体,F的L层电子数等于K、M两个电子层上的电子数之和。(用元素符号或化学式填空回答以下问题)
(1)B为________,D为________,E为________。
(2)C元素在周期表中的位置________。
(3)B、D两元素形成化合物属(“离子”或“共价”)化合物________。
(4)F原子结构示意图为________。
(5)写出BD2和E2D2的电子式:_______;_______。
(6)B、C、D的最简单氢化物稳定性由强到弱依次为:______。(填化学式)
(7)写出F元素的最高价氧化物的水化物和B反应的化学方程式:________。
(8)E与F两元素可形成化合物,用电子式表示其化合物的形成过程:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,错误的是
A.IIA元素在自然界中都以化合态存在
B.VA族元素都是非金属元素
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB10个纵列的元素都是金属元素
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度和压强下,2体积AB2气体和1体积B2气体化合生成2体积气态化合物,则该化合物的化学式为
A. AB3 B. AB2 C. A3B D. A2B3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,可溶于水,密度小于1 g·mL-1,沸点约为56 ℃。要将丙酮从水与丙酮的混合物中分离出来,最合理的方法选择是( )
A. 过滤 B. 蒸馏 C. 蒸发 D. 干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com