
科目: 来源: 题型:
【题目】将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
A. 用N2表示的反应速率为0.15mol·L-1·s-1 B. 2s时H2的转化率为40%
C. 2s时N2与H2的转化率相等 D. 2s时H2的浓度为0.6mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
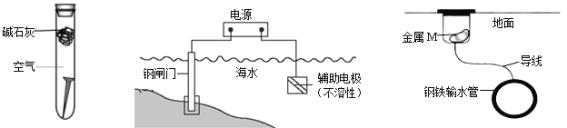
图① 图② 图③
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若断开电源,钢闸门将发生吸氧腐蚀
C. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生可逆反应2NO(g)+O2(g)![]() 2NO2(g),不能说明该反应已经达到平衡状态的是
2NO2(g),不能说明该反应已经达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成NO的速率相等
B. 反应容器中压强不随时间的延长而变化
C. 混合气体颜色深浅保持不变
D. 混合气体的密度不随时间延长而变化
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案,其中t3 <t2 <t1:
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | |||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 | t1 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 | t2 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | t3 |
请回答:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。当观察到紫色刚好褪去,参加反应的H2C2O4和KMnO4的物质的量之比为n(H2C2O4)∶n(KMnO4)=_________。
(2)实验①测得KMnO4溶液的褪色时间为t1=40s,忽略混合前后溶液体积的变化,这段时间内平均反应速率υ(KMnO4)=___________mol/(L·min)。
(3)根据表中的实验②和实验③数据,可以得到的结论是__________________________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图a所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应当如图b所示:

该小组同学根据图b所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是__________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 向试管中加入少量固体 | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
④ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | _____ | t4 |
③若该小组同学提出的假设成立,应观察到的现象是___________________________。
查看答案和解析>>
科目: 来源: 题型:
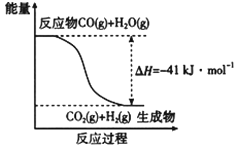
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示,反应的热化学方程式为____________________________________________。
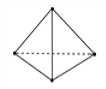
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,1mol N4生成N2的ΔH=_________ kJ·mol-1
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。298K时,已知:
①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=a kJ·mol-1
CO2(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=b kJ·mol-1
2H2O(l) ΔH2=b kJ·mol-1
③2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
则反应:2C(s,石墨)+H2(g)![]() C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是____________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法比较
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se,工业上从其中回收硒(Se)、碲(Te)的一种工艺流程如下:

已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
(1)SeO2与SO2通入水中反应的化学方程式为_____________________________操作①的名称为__________。
(2)焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、_______。工业上通过电解溶液①也可得到单质碲。已知电极均为石墨,则阴极的电极反应式为___________________________。
(3)向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是_________________________________。
(4)将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】纯净的过氧化钙(CaO2)是白色的粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
其制备过程如下:
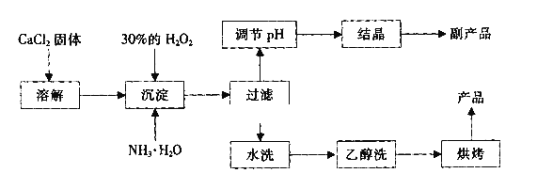
(1)用化学方程式表示出过氧化钙用做水产养殖增氧剂的原理:_______________。
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是__________________。
(3)该制法的副产品为___________(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入下列试剂中的____________(填写A或B)。
A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加__________进行检查。
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2 mol·L—1的H2SO4溶液,充分反应。
第二步,向上述锥形瓶中加入几滴淀粉溶液。
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。 (已知:I2+2S2O32-=2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是___________________________________;
②CaO2的质量分数为______________________________________(用字母表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com