
科目: 来源: 题型:
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
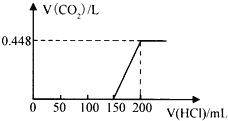
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案能达到目的的是( )
A.用浓硫酸干燥NH3
B.用乙醇萃取碘水中的碘单质
C.用加热的方法除去NaCl固体中的少量NaHCO3
D.用KSCN溶液鉴别Fe2(SO4)3溶液和FeCl2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A.氢氧化钡溶液与稀硫酸混合:Ba2++SO42-→BaSO4↓
B.Fe与HCl反应:2Fe+6H+→2Fe3++3H2↑
C.碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O
D.醋酸与氢氧化钠溶液反应:CH3COOH+OH-→CH3COO-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)0.200 0 mol·L-1的盐酸来滴定待测溶液,不可选用________(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视_______;在铁架台上垫一张白纸,其目的是_________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。

查看答案和解析>>
科目: 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
Ⅰ.已知反应:①CH4(g)+H2O (g) ![]() CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②C(s)+H2O (g) ![]() CO(g)+ H2(g) ΔH=+131 kJ·mol-1
CO(g)+ H2(g) ΔH=+131 kJ·mol-1
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。CH4(g) ![]() C(s)+2H2(g) ΔH=________kJ·mol-1。
C(s)+2H2(g) ΔH=________kJ·mol-1。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是_______(填序号)
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
Ⅱ.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:
(1)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
A.v(H2)正=v(CH3OH)逆 B.2v(CO)=v(H2)
C.CO与H2转化率相等 D.CO与H2的物质的量之比不再改变
(2)图是该反应在不同温度下CO的转化率随时间变化的曲线。温度T1和T2大小关系是T1____T2(填“>”、“<”或“=”),对应温度的平衡常数大小关系是K1____K2(填“>”、“<”或“=”)。
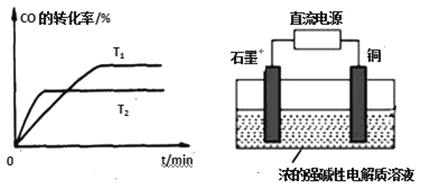
(3)用甲醇燃料电池作为直流电源,设计如图2装置制取Cu2O,写出铜电极的电极反应式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示。请回答下列问题:

(1)装置B的作用是________________。
(2)装置C中发生反应的离子方程式是_____________________________。
SO2在装置D中完全转化为酸式酸根离子的过程中,溶液颜色变化是________。
(3)已知酸性:HCl>H2SO3>HClO。向Na2SO3溶液中加入盐酸酸化的NaClO溶液时,证明NaClO不足时的试剂是________。
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka大于其水解平衡常数Kh。______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子中,能大量共存的一组是…………………………………………( )
A.K+、NO3-、Na+、CO32-B.Na+、Cl-、H+、HCO3-
C.Mg2+、Al3+、Cl-、OH-D.Ca+、CO32-、K+、OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
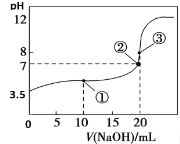
A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com