
科目: 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A.CaCO3 ![]() CaO+CO2↑B.SO3 + H2O=H2SO4
CaO+CO2↑B.SO3 + H2O=H2SO4
C.AgNO3+NaCl=AgCl↓+NaNO3D.Fe+CuSO4=FeSO4+Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】电镀行业中废水处理后产生的含重金属污泥废弃物称为电镀污泥,被列入国家危险废物名单中的第十七类危险废物。工业上可利用某电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金金属,其利用回收流程如下:

已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀的pH | 2.1 | 4.7 | 4.3 |
恰好完全沉淀的pH | 3.2 | 6.7 | a |

(1)浸出过程中的生成物主要是Fe2(SO4)3和_______________(填化学式)
(2)除铁等相关操作:
①加入石灰乳调节pH应满足要求是_______________;
②将浊液加热到80℃,趁热过滤。滤渣Ⅱ的主要成分是______________(填化学式)。
(3)还原步骤中生成Cu2O固体的离子反应方程式______________,此步骤中加入NaHSO3的不能过量______________ (离子方程式表达)。
(4)当离子浓度≤1×10-5mol·L-1时认为沉淀完全,则表格中a的值是______________。(已知:T=25℃,Ksp[Cr(OH)3]=6.3×10-31,![]() ,lg2=0.3)
,lg2=0.3)
(5)将铬块加入到稀盐酸或稀硫酸中,可观察到铬逐渐溶解,同时放出氢气。但若将铬块加稀硝酸中,却看不到明显现象。由此推测,出现该现象的可能原因是____________________________。
(6)处理大量低浓度的含铬废水(以CrO42-计)可采用离子交换法,其原理是采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应。一段时间后停lh 通废水,再通NaOH溶液时CrO42-进入溶液回收,并使树脂得到再生。请用离子方程式表示该交换过程____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组对铁生锈进行研究。
(1)甲同学设计了 A、B、C三组实验如图:

探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是: A中铁钉生诱;b中铁钉不生锈;C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是______________________________;
②铁钉发生电化学腐蚀的正极电极反应式为______________________________;
③实验B所用的水要经过________处理,植物油的作用是_________________;
④实验C中碱石灰的作用是______________________。
(2)乙同学为了达到同样目的,设计了实验d如图所示:

发现一段时间后,试管中的液面升髙,其原因是____________________________,该实验_______(填“能”或“不能”)说明水对铁钉生锈产生影响。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了如图装置制取和验证SO2的性质。
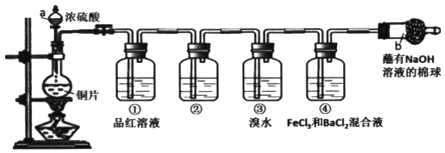
请回答:
(1)写出图中仪器的名称:a________,b________。
(2)棉球中NaOH溶液的作用是________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_______。
A 紫色石蕊试液 B 无色酚酞试液 C 澄清石灰水 D 碘水
(4)下列说法正确的是_______。
A 实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B 先向装置中加入试剂(药品),再进行气密性检查
C 实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D 实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】钛被誉为“21世纪的金属”,在工农业生产、医疗、国防、科技等方面中有着极其广泛而重要的用途。四氯化钛是工业上制备金属钛的重要原料。在常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4的反应原理为:TiO2+2C+2Cl2![]() =TiCl4+2CO。
=TiCl4+2CO。
下图是实验室模拟工业生产制备四氯化钛的反应装置,其主要操作步骤有(顺序己打乱):
①连接好整套装置,并检査装置的气密性;
②当锥形瓶中的TiCl4的量不再增加时,停止加热,改通CO2气体直至电炉中的瓷管冷却为止;
③将Ti02、炭粉混合均匀后,装入管式电炉中;
④将电炉升温至800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水;
⑤通入干燥的CO2气体并持续一段时间。

试回答:
(1)仪器F的名称是_______________,装罝A所用的试剂名称是_______________。
(2)正确的操作程序是(填写操作步骤的序号)______________________________。
(3)操作⑤的目的是______________________________。
(4)装置中冷凝管进水口的位置是(填a或b)_______________,装置E的作用_______________。
(5)将少量TiCl4露置于空气中,可能看到的现象是______________________________。
(6)利用化合物TiCl4可制备TiO2,请结合化学用语解释该过程:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】充分浸泡大豆和水稻籽粒,结果大豆种子膨胀的体积比水稻大,原因主要是大豆种子
A.原有的含水量比水稻小
B.种皮具有较强的渗透吸水能力
C.含蛋白质较多,亲水性较强
D.含糖类较多,细胞液浓度大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)![]() 3Ca2+(aq)+2PO43﹣(aq)
3Ca2+(aq)+2PO43﹣(aq)
(1)溶度积Ksp=_________________;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 molL﹣1,c(PO43﹣)=1.58×10﹣6 molL﹣1,Ksp=___________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com