
科目: 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与12C是同位素
查看答案和解析>>
科目: 来源: 题型:
【题目】有四种元素 A、B、C、D,其中 B2-离子与 C+离子核外都有二个电子层,B 原子的质子数与 C 原子的 质子数之和等于 D 原子的质子数,A 原子失去一个电子后变成一个质子,试回答:
(1)A、B、C、D 的元素符号分别为____、____、____、____。
(2)B2-的电子式 ________,D 原子的原子结构示意图为____,B 与 C 形成的简单化合物的电子式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸铁锂电池是绿色环保型电池,电池的总反应为:Li1-xFePO4+LixC6= LiFePO4+C6。
(1)LiFepO4中Fe2+的价电子排布图(轨道表达式)为___________,该电池反应物中涉及第二周期的元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(2)H3PO4和H2CO3中P和C原子的杂化方式_____(填“相同”或“不相同”)。PO43-的空间结构为___________。
(3)石墨可用作锂离子电池的负极材料,Li+嵌人石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如右图所示,则x=___________;若每个六元环都对应一个L i+,则化学式为___________。

(4)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中位置如图所示,其堆积方式为___________,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________(用最简整数比表示)。假设晶胞边长为a nm,则两个最近的Li+的距离为___________nm。
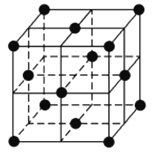
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关烷烃的叙述中,不正确的是
A.分子通式为CnH2n+2 (n为大于等于1的整数)
B.在光照条件下能与氯气发生取代反应
C.能燃烧,发生氧化反应
D.能使酸性KMnO4溶液的紫色褪去
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物(NOx)是电厂主要排放污染物之一。工业上采用氨脱硝处理后排放,原理如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1
4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1
②4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H2=akJ·mol-1
5N2(g)+6H2O(g) △H2=akJ·mol-1
当反应温度过高时,NH3会发生氧化反应:③NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)、△H3=-902.0kJ·mol-1
4NO(g)+6H2O(g)、△H3=-902.0kJ·mol-1
回答下列问题:
(1)有利于提高反应①中NO转化率(脱硝率)的条件是___________(填标号)。
A.高温低压 B.低温低压 C.低温高压 D.增大氨气浓度
(2)反应②中的a=___________。温度下,实验室在2L密闭容器中加入2 molNH3、3 molNO模拟反应②,达到平衡时测得脱硝率为60%,则平衡常数Ke=___________(只列出计算式,不必求出计算结果)。
(3)反应③中,常用的催化剂有Cr2O3和Fe2O3,Cr2O3的催化效率更好一些。下列表示两种催化剂在反应③催化过程中的能量变化示意图合理的是___________(填字母序号)。

(4)下图为混合气中O2含量6%时,不同温度下脱硝率的变化曲线[其中氨氮摩尔比RNS=n(NH3)/n(NO)],由图可知:
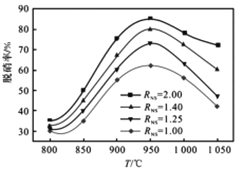
(i)氨氮摩尔比对脱硝率的影响规律是______________________。
(ⅱ)温度在800-950℃变化时,脱硝率随温度升高而___________,但高于950℃后,脱硝率反而下降,一方面是由于平衡移动的影响,另一方面是由于___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将30 mL 5 mol/L NaOH溶液加水稀释到60 mL,稀释后溶液中NaOH的物质的量为( )
A.0.25 molB.2.5 mol
C.0.15 molD.1.5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示的实验装置A加热Cu(NO3)2固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色
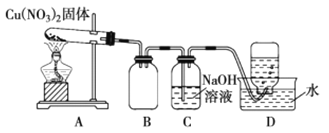
(1)装置A发生反应中氧化产物与还原产物的体积比是___________(相同条件下)。
(2)装置B的作用是___________,反应一段时间后,将带火星的木条放入B中,木条复燃,说明该红棕色气体可助燃,原因是______________________。
(3)已知NO2和NaOH溶液反应可生成两种钠盐,装置C中发生的离子方程式为_________。
(4)将反应后试管中的固体加水充分溶解、过滤、洗涤,向滤渣中加入一定量稀硫酸,发现固体全部溶解,得到蓝色溶液,分为两份。
①一份溶液经___________、___________、___________、洗涤得蓝色晶体。
②另一份取20mL溶液,加入过量KI,充分反应后,用0.5000mol·L-1的Na2S2O3溶液来滴定反应产物,终点时消耗Na2S2O3溶液40.00mL,则上述溶液中c(Cu2+)=___________ mol·L-1。(已知2Cu2++4I-=2CuI↓+I2;I2+2S2O32-=21-+S4O62-)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是
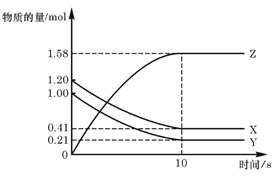
A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是
A. 浓盐酸放置一段时间后浓度变小
B. 钢铁制品在潮湿的环境中生锈
C. 澄清的石灰水变浑浊
D. 氢氧化钠的表面发生潮解
查看答案和解析>>
科目: 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com