
科目: 来源: 题型:
【题目】金属是不可再生的资源,通过回收废旧的锂电池提取锂、铝、钴等重要的金属具有重大的意义。已知锂电池的正极材料为LiCoO2、炭黑、铝箔及有机粘合剂,下面是回收的工艺流程:

(1)滤液X中通入过量CO2时发生的主要反应的离子方程式为___________
(2)写出酸浸时加入H2SO4、H2O2反应的化学方程式______________________
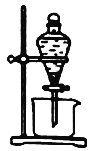
(3)实验室中萃取分离CoSO4、Li2SO4溶液时需要加入有机物W,若实验过程中使用如图装置,则该装置中存在的主要错误有______________________
(4)已知部分物质的溶解度(g/100gH2O)情况如下表所示:
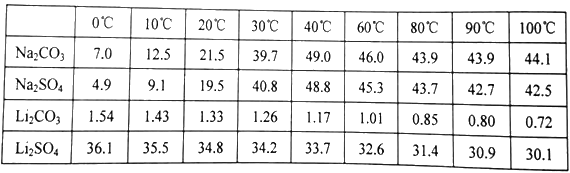
写出浓缩后的溶液中加入饱和碳酸钠溶液的离子反应方程式______________________;为提高Li2CO3的产率,最后过滤实验中需要注意的问题是______________________
(5)若废旧的锂电池拆解后先使用酸溶解,最终也可以得到Al(OH)3、CoSO4、Li2CO3。在酸浸中若Al3+浓度为0.1moL·L-1,则常温时pH>______________________才能够开始形成氢氧化铝沉淀(已知氢氧化铝Ksp=1.3×10-33、lg4.26=0.6、![]() =2.35)
=2.35)
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,若按照上述生产流程,可以生成2.4gLi2CO3,则其产率为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定容积的密闭容器中进行反应;N2(g)+3H2(g)![]() 2NH3(g)。己知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
2NH3(g)。己知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
A. N2为0.2mol/L;H2为0.6mol/L B. N2为0.15mol/L
C. N2、H2均为0.18 mol/L D. NH3为0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中可逆反应mA(g)+nB(g) ![]() pC(g)+qQ(g) 当m、n、p、q为任意整数且C为有色物质,可逆反应一定达到平衡的标志是 ( )
pC(g)+qQ(g) 当m、n、p、q为任意整数且C为有色物质,可逆反应一定达到平衡的标志是 ( )
①混合气体的平均摩尔质量不再改变 ②体系的温度不再改变③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率VA:VB:VC:VQ=m:n:p:q ⑥体系颜色不再变化
⑦单位时间内m mol A断键反应,同时p mol C也断键反应
A. ②③④⑤⑥ B. ①②③④⑤ C. ②③④⑥⑦ D. ①②③④⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列盐水解的离子方程式:
NaClO________________。
(NH4)2SO4________________。
Na2SO3 ________________。
AlCl3________________。
(2)25 ℃,将0.2 mol·L-1 HA溶液与0.2 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则:(下列空白填“>”“<”或“=”)
①混合溶液中,c(HA)________c(A-)。水电离产生的c(OH-) _____ 10-7 mol·L-1
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
③混合溶液中,由水电离出的c(OH-)___原0.2 mol·L-1 HA溶液中由水电离出的c(H+)。
④25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度______NaA的水解程度。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,有pH值为12的NaOH溶液100 mL,欲将其pH值变为11,采取下列三种措施(设混合后溶液的体积等于两混合溶液体积之和)。请回答有关问题:
①若加水,应加入约________ mL。
②若用pH=10的NaOH溶液,应加入此NaOH溶液________ mL。
③若用pH=2的盐酸,应加入________ mL。
(2)pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL, 其pH的变化如图所示

①稀释前两溶液的浓度c(HA)________c(HB)(填>.<.=,或无法确定)
② HB _______ 是弱酸 (填“一定”、“可能”或“一定不”)
③若 a = 5,则HA酸是否是强酸 ____(填“一定是”、“可能是”、 “一定不是”或“无法确定”)
④稀释后的溶液中,由水电离产生的c(H+): HA中_____ HB中(填>.<.=,或无法确定)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,纯水电离达到平衡后,向水中溶入下列物质后,可促进水的电离的有_____可抑制水的电离的电解质有 _____
①Na2CO3 ②NaHSO4 ③ 蔗糖 ④ C2H5OH ⑤ KNO3 ⑥ H2CO3 ⑦AlCl3 ⑧ SO3
(2)向0.1mol/L 的氨水中再通入少量氨气,填“增大”减小或不变:
c(NH4+)/c(NH3·H2O ) ______ c(H+ )_____ 氨水电离转化率 ____
(3)比较下列溶液的pH值(填>.<.=)
①0.1 mol·L- 1 NH4Cl溶液___________0.01 mol·L- 1 NH4Cl溶液
②0.1 mol·L- 1 Na2CO3溶液 __________0.1 mol·L- 1 NaHCO3溶液
③25℃,1 mol·L- 1 FeCl3溶液__________80℃,1 mol·L- 1 FeCl3溶液
④0.1 mol·L- 1 NaOH 溶液___________0.1 mol·L- 1 Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】把金属A放入盐B(NO3)2的溶液中,发生如下反应:A+B2+=A2++B,以下叙述正确的是( )
A.常温下金属A一定能与水反应,B一定不能与水反应
B.A与B用导线连接后放入酒精中,一定形成原电池
C.A、B用导线连接后放入B(NO3)2的溶液中,一定有电流产生
D.由A与B形成的原电池,A一定是正极,B一定是负极
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的合成与应用一直是众多科学家研究的热门话题,目前该研究领域已经催生了三位诺贝尔化学奖得主,N2不仅可以与H2合成氨气,N2还可以与其他物质反应生成氨气,回答下列相关问题:
(1)德国化学家哈伯研究“N2(g)+3H2(g)![]() 2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2
2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2
①若从平衡常数角度分析,反应限度已经较大,但为何化工生产中还需要使用催化剂:____________________________________________
②升高温度,反应物的转化率会降低,而实际化工生产中常常采用700K左右的温度,其原因是____________________________________________。
(2)1931年,科学家卡尔博施因改进合成氨方法而荣获该年度诺贝尔化学奖。研究发现,催化剂Fe3O4·Al2O3)颗粒大小不同、温度不同,平衡混合气体中氨气的含量不同由如图可以得出合成氨的适宜条件是_________________________________

(3)2007年,德国埃特尔发现了合成氨催化机理,开端了表面动力学的研究。研究发现,常温恒压密闭容器中,N2在催化剂表面可以与水发生反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
①下列各项能够作为判断该反应一定达到平衡的依据是___________(填标号)。
A.容器中N2(g)、NH3(g)、O2(g)的浓度之比为2:4:3
B.N2与NH3浓度之比恒定不变
C.v(N2)正=2v(NH3)逆
D.混合气体中氨气的质量分数不变
E.压强保持不变
②平衡后若分别改变下列一个条件,可以使N2转化率增大的是___________(填标号。)
A.转移掉部分O2 B.转移掉部分NH3
C.适当增加H2O(l)的量 D.增加N2的量
(4)科学研究发现,天然气CH4(g)与N2(g)在催化剂作用下可以直接用于合成氨气,同时生成副产物焦炭,已知每转移1mol电子,该反应吸收的热量为QkJ。
①写出该反应的热化学反应方程式_________________________________
②700℃时,将3molCH4与3molN2在2L的恒定密闭容器中发生上述反应,达到平衡时生成 amolC,求此时混合气体中氨气的体积分数______________________(用含a的数学表达式即可,下同);该温度下的平衡常数Kc=_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作:①过滤;②取固体试剂;③蒸发;④取液体试剂;⑤溶解。一定要 用到玻璃棒的是( )。
A. ①③⑤ B. ②③④ C. ①③④ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com