
科目: 来源: 题型:
【题目】下图是工业制纯碱的部分物质转化示意图,下列说法错误的是

A. X是NH3,Y是CO2
B. M可在转化流程中循环利用
C. 若是联合制碱法,则L的主要成分是NH4Cl
D. 若是氨碱法,溶液c可在转化流程中循环利用
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。能判断该反应已经达到化学平衡的是( )
2NH3(g)+CO2(g)。能判断该反应已经达到化学平衡的是( )
①v(NH3)正=2v(CO2)逆 ②密闭容器中总压强不变 ③密闭容器中混合气体的密度不变 ④密闭容器中混合气体的平均相对分子质量不变 ⑤密闭容器混合气体的总物质的量不变⑥密闭容器中CO2的体积分数不变 ⑦ 混合气体总质量
A. ①②③⑤⑦ B. ①②⑤⑦ C. ①⑤⑥ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】关于铝及其化合物的离子方程式正确的是
A. 向NaOH溶液中加入铝粉:Al + OH—+ H2O → AlO2— + H2↑
B. 向AlCl3溶液中通入过量氨气:Al3+ + 3OH— → Al(OH)3 ↓
C. 向Al(OH)3 中加入NaOH溶液 :Al(OH)3 + OH— → AlO2— + 2H2O
D. 明矾净水的原理:Al3+ + 3H2O ![]() Al(OH)3↓ + 3H+
Al(OH)3↓ + 3H+
查看答案和解析>>
科目: 来源: 题型:
【题目】以NA代表阿伏加德罗常数的数值,则关于热化学方程式C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A. 转移10NA个电子时,该反应放出1300 kJ的能量
B. 生成NA个液态水分子时,吸收1300 kJ的能量
C. 有2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 有10NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】关于右图所示装置(海水为弱碱性)的说法错误的是

A. 若d为石墨,则铁片上的电子反应为:Fe —2e → Fe2+
B. 若d为铜片,则铁片腐蚀加快
C. 若d为锌片,则铁片上的电极反应为:2H+ +2e → H2↑
D. 若d为锌片,则这种保护铁片的方法属于牺牲阳极的阴极保护法
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子化合物G是一种重要的化工产品,可由烃A(C3H6)和苯合成。合成G的流程图如下:

已知:①B和C中核磁共振氢谱分别有4种和3种峰。
②CH3Cl+NaCN→CH3CN+NaCl
③CH3CN![]() CH3COOH
CH3COOH
④![]()
请回答下列问题:
(1)A的名称是___________。
(2)①的反应类型是___________,⑥的反应类型是___________。
(3)D的结构简式是______________________。
(4)E中官能团的名称是___________。
(5)⑦的反应方程式是_________________________________。
(6)F的同分异构体有多种,符合下列条件的有___________种。
①苯环对位上有两个取代基,其中一个是NH2 ②能水解 ③核磁振谱有5个峰
写出符合上述条件的一种同分异构体的结构简式______________________。
(7)参照上述流程图,写出用乙烯、NaCN为原料制备聚酯 的合成路线___________(其它无机物任选)
的合成路线___________(其它无机物任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】将6.5g锌投入200 mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)6.5 g锌的物质的量为__________;
(2)所用盐酸中HCl中的物质的量浓度为__________。
(3)反应中生成的H2在标准状况下的体积为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I. 如下图所示,50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在装置中进行中和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
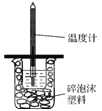
(1)图中装置缺少的仪器是 _______________。
(2)下列说法不正确的是________________ (填序号)。
A.若用50mL 0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL 0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B.用标准溶液润洗滴定管2-3次;
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
E.调节液面至0或0刻度以下,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)___________________.
(2)实验中眼睛注视_____________,直至滴定终点。判断到达终点的现象是___________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL,则c(HCl)=______。
(4)下列操作中,可能造成测定结果偏高的是________________。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图实验装置回答问题
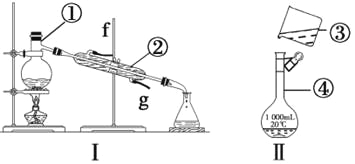
(1)写出下列仪器的名称:①___________,②____________,④____________。
(2)仪器①~④中,使用时必须检查是否漏水的是_____________(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器__________,将仪器补充完整后进行的实验操作的名称为____________;②的进水口是___________(填“f”或“g”)。
(4)现需配制250 mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误之处:①_____________________;②_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com