
科目: 来源: 题型:
【题目】下列关于影响化学反应速率的条件的说法正确的是( )
A.增大压强一定能加快化学反应速率
B.使用催化剂对化学反应速率没影响
C.增加反应物的量一定能加速化学反应速率
D.升高温度,一般能加快化学反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验。已知无色气体B能形成酸雨。请回答:
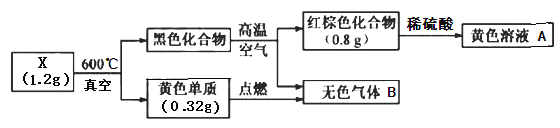
(1)X的化学式是________。
(2)设计实验方案检验黄色溶液中的金属阳离子___________________。
(3)将无色气体B通入黄色溶液A中,发现溶液变成浅绿色。请用离子方程式表示该反应_________
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活息息相关。下列说法正确的是
A.矿泉水中不含任何化学物质B.聚乙烯不能使酸性高锰酸钾溶液褪色
C.碳酸钡可用作医疗上的“钡餐”D.氢氧化钠可用作治疗胃酸过多的药物
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0
N2(g)+2CO2(g) ΔH<0
①一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.N2和CO2的体积比保持不变 D.v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图所示的变化,则改变的条件可能是______(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2的量 D.缩小容器体积

(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g) +NO(g),正反应速率随时间变化如图所示。由图可得出的正确结论是__(填字母)
SO3(g) +NO(g),正反应速率随时间变化如图所示。由图可得出的正确结论是__(填字母)

A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图回答问题。

催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g)ΔH=-92.9kJ/mol,300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g)ΔH=-92.9kJ/mol,300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH浓度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收c kJ | ||
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法中正确的是____________
A.2c1>c3 B.a+b=92.9 C.2p2<p3 D.α1+α3<1
查看答案和解析>>
科目: 来源: 题型:
【题目】将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为____________,H2(g)的平衡转化率为___________,在此温度下,该反应的平衡常数K=____________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是_________(填入下列条件的序号,下同),乙条件可能是__________。
① 恒容条件下,升高温度
② 恒容条件下,降低温度
③ 恒温条件下,缩小反应容器体积
④ 恒温条件下,扩大反应容器体积
⑤ 恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是___________(用含一个a、b、c的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列四组实验描述不正确的是
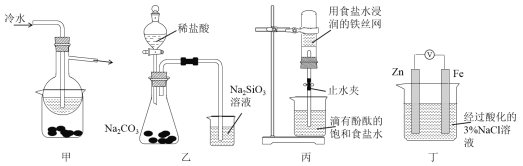
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】X是合成一种新型抗肝炎药的中间体,其生产路线如下:
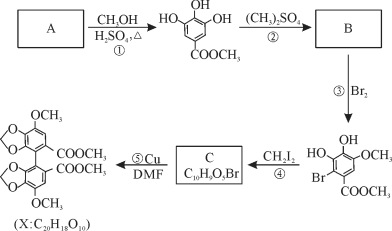
回答下列问题:
(1)反应①的反应类型为_____________。
(2)反应③的化学方程式为____________________________________________________。
(3)反应④生成C的结构简式为______________________,无机产物为_____(填化学式)。
(4)A有多种同分异构体,同时符合下列条件的有______种(不考虑立体异构)。请写出其中一种核磁共振氢谱有4组峰,且峰面积之比为2∶2∶1∶1的结构简式___________。
a.苯环上有4个取代基;
b.与FeCl3溶液发生显色反应;
c.能发生水解反应。
(5)参照上述合成路线及信息,以氯气、苯和一氯乙烯为原料(其它试剂任选),设计制备聚苯乙烯的合成路线____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是
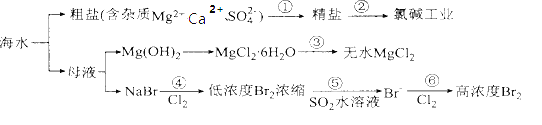
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.
A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸
B.过程②通过氧化还原反应可产生1种单质
C.在过程③中将MgCl26H2O直接灼烧得到MgCl2
D.在过程④、⑥反应中每氧化0.2molBr-需消耗标准状况下2.24LCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_____________,电负性由大到小的顺序为__________________________________________________。
(3)H2O 与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是_________________________________________。
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_____________,所含共价键的类型为_____________,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为________________________________________。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
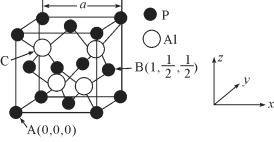
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_____________。
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为_____________(列出计算式即可,用NA表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】从报废后的锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等)中回收有关物质,回收工艺流程如下:
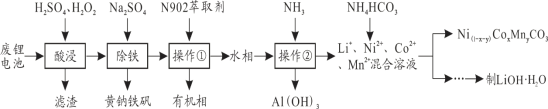
(1)操作②的名称为_______________,操作①的目的是___________________________。
(2)写出酸浸过程中LiCoO2发生氧化还原反应的化学方程式_______________________。
(3)室温下,各物质的Ksp如下表所示:(已知:lg2=0.3、1g6=0.8)
物质 | Al(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
Ksp | 1×10-35 | 2×10-13 | 6×10-15 | 4×10-15 |
若水相中各金属离子浓度均为0.1mol/L,且离子浓度小于1.0×10-5mol/L,即认为该离子已完全除去,操作②需调节溶液pH的取值范围为_________。(保留1位小数)
(4)某锂离子电池正极材料含有LiNi1/3Co1/3Mn1/3O2,其中Ni、Co的化合价分别为+2、+3,则Mn的化合价为_______。该材料可通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到,反应中不能隔绝空气,其原因是_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com