
科目: 来源: 题型:
【题目】A、B 两种元素为同一族第三周期和第四周期元素,若 A 元素的原子序数为 x,则 B 元素的原子序数可能为( )
①x+2 ②x+8 ③x+18 ④x+32
A.③B.②C.②③D.①②
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。
Ⅰ.实验室制备NaN3
(1)实验原理:
①把氨气通入熔融金属钠反应制得氨基钠(NaNH2),该反应的化学方程式为____________。
②将生成的NaNH2与N2O在210℃-220℃下反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______。
(2)实验装置(图1)、步骤如下,回答下列问题:
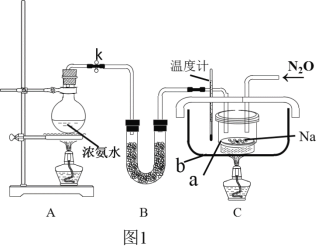
已知:i)NaN3是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
ii)NaNH2的熔点为210℃,沸点为400℃,在水溶液中易水解。
①组装仪器检查装置气密性后,装入药品。装置B中盛放的药品是_______________。
②实验过程应先点燃___(填“A”或“C”)处的酒精灯,理由是_______________________。
③让氨气和熔化的钠充分反应后,停止加热A并关闭止水夹k。向装置C中b容器内充入加热介质植物油并加热到210℃-220℃,然后按图通入N2O;
④装置C反应完全结束后,冷却,取出a中的混合物进行以下操作,得到NaN3固体:

操作II的目的是____________;
操作IV中选用的洗涤试剂最好的是_____。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
(3)图中仪器a用不锈钢材质的而不用玻璃的,其主要原因是____________________。
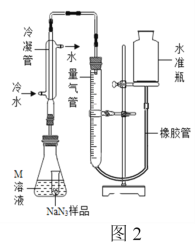
II.产品NaN3纯度测定
精确称量0.150 g NaN3样品,设计如图2所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度。
已知2 NaN3→ 3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)使用冷水冷凝的目的是______。对量气管读数时,反应前后都需要进行的操作是______。
(5)常温下测得量气管读数为60.0 mL(N2的密度为1.40 g/L)计算NaN3样品的纯度为______。(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:

(1)表中用于半导体材料的元素在周期表中的位置________________________。
(2)写出短周期金属性最强的元素的离子结构示意图:_____。
(3)③、④、⑤三元素离子半径从大到小的顺序是________________填离子符号)。
(4)②、③、④的气态氢化物,稳定性最强的是_______________填化学式)。
(5)设计实验证明⑤、⑥的金属性强弱__________________________。
(6)在一定条件下,利用置换反应可实现物质之间的转化(仅限于①-⑨中涉及的元素)
①同族元素之间,则反应可能为_____________。
②不同族元素之间,则反应可能为_____________(以上反应各写一条化学方程式即可)。
(7)将⑨的单质通入石蕊溶液中发生的颜色变化如下图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。_____________、_____________、_____________。
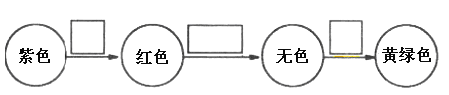
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2X溶液中滴加0.2mol/L NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法不正确的是
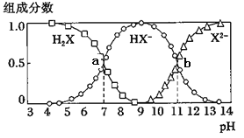
A. 水的电离程度: b点大于点a
B. 将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C. 常温下HY的K=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y—=HY+HX—
D. 常温下,反应X2— + H2O ![]() HX— + OH—的平衡常数对数值1gK= -3
HX— + OH—的平衡常数对数值1gK= -3
查看答案和解析>>
科目: 来源: 题型:
【题目】德国化学家凯库勒认为:苯分子是由6个碳原子以单双键相互交替结合而成的环状结构为了验证凯库勒有关苯环的观点,甲同学设计了如图实验方案.

①按如图所示的装置图连接好各仪器;②检验装置的气密性;③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压預先装有水的胶头滴管的胶头,观察实验现象.
请回答下列问题.
(1)A中所发生反应的反应方程式为_____,能证明凯库勒观点错误的实验现象是______.
(2)装置B的作用是______.
(3)C中烧瓶的容积为500mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对氢气的相对密度为35.3,则实验结束时,进入烧瓶中的水的体积为______mL 空气的平均相对分子质量为29.
(4)已知乳酸的结构简式为![]() 试回答:
试回答:
①乳酸分子中含有______和______两种官能团写名称.
②乳酸跟氢氧化钠溶液反应的化学方程式:______.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. CH3CH2CH(CH3)CH3的名称为3一甲基丁烷
B. CH3CH2CH2CH2CH3和CH3CH2CH(CH3)CH3互为同素异形体
C. ![]() 和
和![]() 为同一物质
为同一物质
D. CH3CH2OH和CH2OHCHOHCH2OH具有相同的官能团,互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体中可能含有Na+、K+、Mg2+、Ba2+、 SO42-、CO32-、SO32-、SiO32-等离子,将其配成100mL溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:

请回答下列问题:
(1)实验中最关键的“定容”操作:当液面接近容量瓶刻度线1-2cm处,________再将容量瓶塞盖好,反复上下颠倒,摇匀。
(2)根据以上实验可得出:一定存在的离子是________,一定不存在的离子是________
(3)下列实验结论符合事实的是________________
A.该固体中可能含有Na2SiO3、K2CO3
B.该固体中一定含有Na2SiO3、K2CO3
C.该固体中可能含有Na2SiO3、K2CO3、K2SO4
D.该固体中可能只含有Na2SiO3、Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素 R 的最高价氧化物的水化物分子式是 HnRO2n﹣2,则在气态氢化物中 R 元素的化合价是( )
A.3n﹣10B.12﹣3nC.3n﹣4D.3n﹣12
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法正确的是
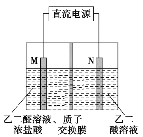
A. M极与直流电源的负极相连
B. 每得到lmol乙醛酸将有2molH+从右室迁移到左室
C. N电极上的电极反应式:HOOC-COOH-2eˉ+2H+ = HOOC-CHO+H2O
D. 每消耗0.1mol乙二醛在M电极放出2.24L气体(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】将8.00gCuO和Fe2O3的混合物分成两等份,其中一份在高温下用足量CO还原后,剩余固体质量为2.88g;另一份固体用200mL某浓度的盐酸恰好溶解,则:
(1)混合物中CuO和Fe2O3的物质的量之比为:________________________
(2)所用盐酸的物质的量浓度为_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com