
科目: 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的核外电子排布图:![]() ,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
(3)基态溴原子的价层电子轨道排布图为_______,第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为_____,已知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。
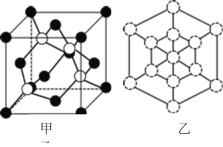
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置_____。
画出B原子的投影位置_____。
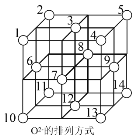
(5)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面休空隙数之比为__________,有__________%的正八面体空隙没有填充阳离子。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)

查看答案和解析>>
科目: 来源: 题型:
【题目】在一个1L的密闭容器中加2molA和1molB发生反应: 2A(g)+B(g)![]() 3C(g)+D(s),达到平衡时C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a% 的是
3C(g)+D(s),达到平衡时C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a% 的是
A. 6mol C+2mol D B. 4mol A+2mol B
C. 1mol A+0.5mol B+1.5mol C D. 3mol C+5mol D
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.5 molL-1min-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.大理石与盐酸反应:CO32﹣+2H+=CO2↑+H2O
B.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C.氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣
D.硫酸与氢氧化钡溶液反应:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。
已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。将烟气通入 (NH4)2SO3溶液可以继续吸收SO2 ,用离子方程式表示出能吸收二氧化硫的原因_________。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______(填选项编号)。
N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______(填选项编号)。
A.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式_______________________________________。
②一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图1所示:
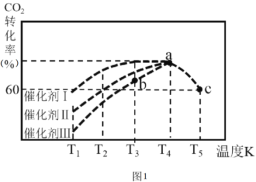
催化剂效果最佳的是催化剂 ______ (填“I”,“Ⅱ”,“Ⅲ”)。b点v(正)___v(逆) (填“>” ,“< ”,“=”)。此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_______。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=________。(保留两位有效数字) (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
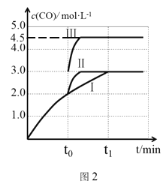
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为__________________。
(2)ZX3分子的空间构型为__________________, ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_______(填化学式),原因是_____________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为:______________________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________(填化学式)。Na+的配位数为________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。
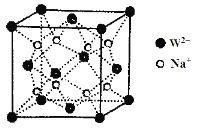
查看答案和解析>>
科目: 来源: 题型:
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
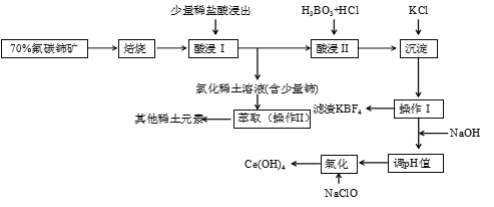
已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:
9CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(BF4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是______________________________________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是_________________________________________________________
(3)向Ce(BF4)3中加入KCl溶液的目的是_____________________________________。
(4)操作I的名称为__________,在实验室中进行操作II时所需要的硅酸盐仪器有______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于_______即可认为Ce3 +已完全沉淀。
(已知:Ksp[Ce(OH)3]=1.0×10-20 )
(6)取上述流程中得到的Ce(OH)4产品5.000 g,加酸溶解后,向其中加入含0.03300 molFeSO4的FeSO4溶液使Ce4 +全部被还原成Ce3 +,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为________(已知氧化性:Ce4+>KMnO4; Ce(OH)4的相对分子质量为208)。
查看答案和解析>>
科目: 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
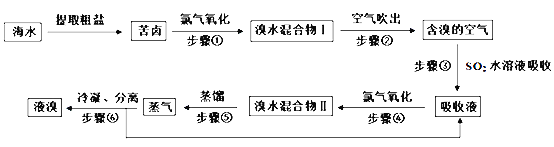
(1)步骤①获得Br2的离子反应方程式为:_________________________。
(2)步骤③所发生反应的化学方程式为:_________________________。在该反应中,氧化剂是______________(填化学式);若反应中生成2molHBr,则转移电子数约为_____________个。
(3)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是:_______________。
(4)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(5)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应的热现象说法不正确的是( )
①放热反应发生时不必加热 ②化学反应一定有能量变化
③吸热反应需要加热后才能发生
④化学反应吸收或放出热量的多少与参加反应的物质多少有关
A.①②B.②③C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com