
科目: 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
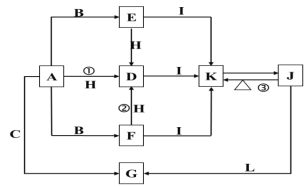
回答下列问题:
(1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。
(2)写出反应①②③的化学反应方程式:
①:____________________________________;
②:____________________________________;
③:____________________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】用双线桥法表示下列反应的电子转移情况并将其改写成离子方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,________________________,离子方程式为________________________。当3.84gCu被氧化时,__________gHNO3被还原,产生标准状况下的气体________L,转移电子数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是

A. KNO3盐桥中的K+移向CuSO4溶液
B. Ag作负极,Cu作正极
C. 工作一段时间后,CuSO4溶液中c(Cu2+)增大
D. 取出盐桥后,电流计的指针依然发生偏转
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在科学研究和化工生产等领域都有着广泛的应用。请回答下列问题:
(1)与氮元素同族的第四周期元素的基态原子价层电子轨道表达式为___________。
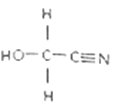
(2)HOCH2CN的结构简式如图,该分子中σ键与π键数目之比为___________,其分子中碳原子的杂化方式为___________,该物质中除氢以外的元素的第一电离能由大到小的顺序为______________________。
(3)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为___________(任写一种)。NH3的 VSEPR模型为___________。[Cu(NH3)4]2+的结构可用示意图表示为______________________。
(4)①已知:2UO2+5NH4HF2![]() 2UF4·NH4F+3NH3↑+4H2O↑,NH4HF2中不含有的作用力为___________(填选项字母)。
2UF4·NH4F+3NH3↑+4H2O↑,NH4HF2中不含有的作用力为___________(填选项字母)。
A.共价键 B.配位键 C.金属键 D.离子键 E.氢键
②NH3和H2O的键角由大到小的顺序为______________________(用分子式表示),原因是_______________________________________________________。
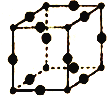
(5)Cu3N的晶胞结构如图所示,N3-的配位数为___________,Cu+半径为apm,N3-的半径为bpm,Cu3N晶胞的密度为___________g/cm3(列出计算式即可,阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.如图所示为常见玻璃仪器的部分结构:
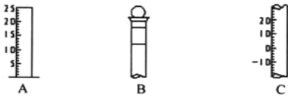
(1)请写出所列仪器的名称:A__________,B____________;C_____________;
(2)仪器 B 使用前必须______________________。
(3)仪器 B 上标记有__________________(填序号);
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II. 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
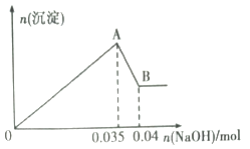
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________________(填离子符号);
(2)写出A→B过程中发生反应的离子方程式:_________________;
(3)该废水中,c(Al3+)=________________________;
(4)①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要________(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)________。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
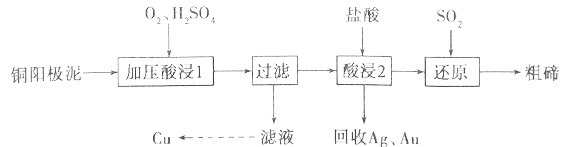
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是__________________________,其中“加压”的目的是______________________。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式_________________________________。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为______________________。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是______________________。
(3)写出“还原”反应中发生的离子方程式_________________________________。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为_________________________________。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=___________(已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一个充满CO2的铝制易拉罐中加入适量的NaOH溶液,并密封,易拉罐会慢慢变瘪,原因是____________(用化学方程式表示,下同)后又慢慢鼓起来,原因是________________。
(2)写出还原铁粉与水蒸气反应的化学方程式_____________________。
(3)实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式:___________;常用澄清石灰水检验CO2气体的离子方程式是__________________________________。将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是________________________________;反应片刻后,可观察到有气体产生,其离子方程式是________________________。
(4)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为___________________________________________。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是
A.Ca2+、Cl-、MnO4-、Na+B.K+、Cl-、SO42-、H+
C.OH-、Na+、Al3+、I-D.H+、Cl-、Ba2+、Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=___________kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________(用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________,O2的转化率为___________(用百分数表示,且保留小数点后一位),该反应的平衡常数为___________(列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________

(3)下列有关该反应的说法正确的是___________(填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com