
科目: 来源: 题型:
【题目】已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是
2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
查看答案和解析>>
科目: 来源: 题型:
【题目】钠的化合物用途广泛,回答下列问题:
(1)多硫化钠(Na2Sx)用作聚合的终止剂。钠原子价层电子的轨道表达式(电子排布图)为___________,基态S原子电子占据最高能级的电子云轮廓图为___________,其中Na2S4中存在的化学键有:___________。
A.离子键 B.极性共价键 C.π键 D.非极性共价键
(2)r(S2-)>r(Na+)的原因是___________。
(3)Na2SO3常用作工业的脱氧剂和漂白剂,其阴离子的中心原子的杂化形式是___________,空间构型是______________________。
(4)下表列出了钠的卤化物的熔点:
化学式 | NaF | NaCl | NaBr | NaI |
熔点/℃ | 995 | 801 | 775 | 651 |
①NaF的熔点比NaI的熔点高的原因是_________________________________;
②NaCl晶格能是786 kJ/mol,则NaF的晶格能可能是___________。
A. 704 kJ/mol B. 747kJ/mol C 928 kJ/mol
(5)NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,则H-的半径为___________pm;NaH的理论密度是___________g·cm-3(保留三位有效数字)。[H—1、Na—23]
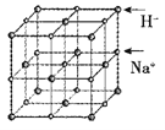
(6)首例被发现的带结晶水的超导材料晶体化学式为Na0.35CoOx·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构,已知CoOx层的构型部分如图,其中粗线画出的是其二维晶跑,则x=___________。
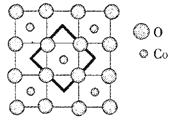
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g)![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
副反应:
反应IV:CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
(1)计算反应Ⅱ的反应热△H2=____________________________________________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:
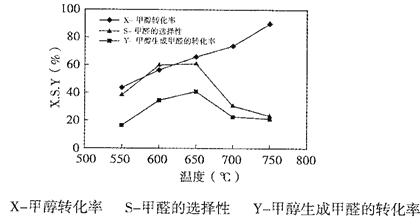
①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因___________;
②反应历程i的活化能___________(填“>、“<”或“=”)CH3OH(g)![]() HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。
③650℃~750℃,反应历程ii的速率___________(填“>”、“<”或“=”)反应历程ⅲ的速率。
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
浓度(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
吹脱时间(h) | 0 | 7 | 23 | 39 | 55 |
则当甲醛浓度为2000mg/L时,其吹脱速率v=___________ mg·L-1·h-1,分析上表数据,起始浓度为10000mg/L,当甲醛浓度降为5000mg/L,吹脱时间为___________h。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于能量变化的说法正确的是( )
A.冰融化成水放出热量
B.生成物的总能量一定低于反应物的总能量
C.金属与酸反应生成氢气的过程吸收热量
D.化学键的断裂和形成是化学反应中能量变化的主要原因
查看答案和解析>>
科目: 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)具有良好的热稳定性、耐热性、电绝缘性,是目前用量最大的热稳定剂,工业上利用铅废渣(主要含PbSO4、 PbCl2、 SiO2)制取三盐基硫酸铅及PbO2工艺流程如下:

已知:①“浸出”过程发生的反应:PbSO4(s)+2Cl-(aq)![]() PbCl2+SO42-(aq)和
PbCl2+SO42-(aq)和
PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0,
PbCl42-(aq) △H>0,
②Ksp(PbCl2)=1.7×10-5 Ksp(PbSO4)=2.5×10-8
回答下列问题:
(1)铅渣“浸出”后,“浸出渣”的主要成分是CaSO4和___________。
(2)“操作1”通过多步操作得到PbCl2,分别为___________、___________、过滤、洗涤。
(3)“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c(SO42-)=___________(结果保留一位小数);“转化”时需要升高体系温度,其原因是_________________________________。
(4)写出合成三盐基硫酸铅的化学方程式_________________________________。
(5)氨水络合后铅的存在形态是[ Pb(OH)SO4]-,写出“氧化”发生的离子反应方程式__________________________________________________________________。
(6)一种新型的铅锂电池的充放电示意图如下,写出放电时的正极反应式___________。

查看答案和解析>>
科目: 来源: 题型:
【题目】工业用空气氧化(NH4)2SO3的方法制取(NH4)2SO4,研究小组用如图装置模拟该过程,并通过测定反应后溶液中SO32-的浓度来计算该反应的转化率。

实验步骤
①按图连接好装置,检查气密性;
②取200mL0.5000mol/L的(NH4)2SO3溶液(含有一定量氨水,pH=8)装入三颈烧瓶中,加入催化剂,控制气体流速为300L/h,控制温度在50℃进行实验;
③反应2.5小时后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器a的名称是____________________________________________。
(2)装置B的作用是_______________________________________________________。
(3)C中(NH4)2SO3被氧化,该反应的离子方程式为______________________;装置C中的反应需要控制溫度在50℃,采用的实验措施是______________________;C中溶液的pH不能低于8,原因是____________________________________________。
(4)取20.00mL反应后的溶液于碘量瓶中,滴入3滴淀粉溶液,用0.1000mol/L的标准碘溶液滴定至终点,消耗碘水体积为18.50mL,则(NH4)2SO3的转化率为_____________________。
(5)指出实验装置存在的缺陷_________________________________(写一条)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置或操作能达到目的的是


A. 装置①用于测定生成氢气的速率
B. 装置②依据褪色快慢比较浓度对反应速率的影响
C. 装置③依据U管两边液面的高低判断Na和水反应的热效应
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将0.1000mol/L的NaOH溶液分别滴加到20.00mL浓度均为0.1000mol/L的一元酸HX和HY溶液中,溶液的pH与所加NaOH体积的关系如图所示,下列叙述错误的是
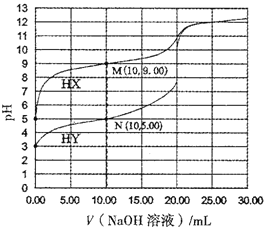
A. N点溶液中c(Y-)>c(Na+)>c(OH-)>c(H+)
B. 常温下,0.1000mol/LHY溶液的电离度约为1%
C. Ka(HX)数量级为10-9
D. 用NaOH溶液滴定HY可用酚酞做指示剂
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所示,下列说法错误的是

A. 反应总过程ΔH<0
B. Fe+使反应的活化能减小
C. FeO+也是该反应的催化剂
D. Fe++N2O![]() FeO++N2、FeO++CO
FeO++N2、FeO++CO![]() Fe++CO2两步反应均为放热反应
Fe++CO2两步反应均为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com