
科目: 来源: 题型:
【题目】实验室用图示装置制备KC1O溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
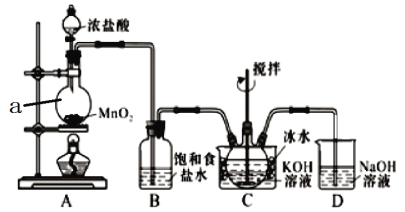
(査阅资料)① Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;② K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称是_________;装置A中反应的化学方程式为__________________。
(2)装置C中三颈烧瓶置于冰水浴中的目的是_________________________________。
(3)装置B吸收的气体是_________,装置D的作用是___________________________。
(4)C中得到足量KC1O后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为__________________________。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0℃~5℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是___________。
(6)若实验中消耗了VmL c mol/L的Fe(NO3)3溶液,Fe(NO3)3充分反应,最终制得a g的K2FeO4固体,则本实验K2FeO4的产率为 ______________(列出算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收b kJ热量
B.该反应的反应热ΔH= +(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A-A键和1mol B-B键,放出a kJ能量
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,电池反应为:4Li+FeS2=Fe+2Li2S。下列说法不正确的是
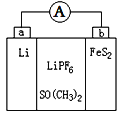
A. 该装置将化学能转化为电能
B. 可以用水代替 SO(CH3)2做溶剂
C. 电子移动方向是由a极经外电路流向b极
D. b极电极反应式是:FeS2+4Li++4e-=Fe+2Li2S
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用H2O2和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) △H=64kJ/mol;2H2O2(l)=2H2O(l)+O2(g) △H= -196kJ/mol;H2(g)+1/2O2(g)=H2O(l) △H= -286kJ/mol.在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为___________。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol.L-1.min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)![]() pC(g)。达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍。则下列说法正确的是( )
pC(g)。达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍。则下列说法正确的是( )
A. m+n>pB. m+n<p
C. 平衡向正反应方向移动D. C的质量分数增加
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)仪器A的名称为_________________________。
(2)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止 温度 t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH = ______ (取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z 三种元素中,可形成含二种元素的10电子微粒m、n、p、q,且有反应m+n![]() p
p![]() +q;M的最高价氧化物对应的水化物为最强酸。则下列说法正确是
+q;M的最高价氧化物对应的水化物为最强酸。则下列说法正确是
A. 原子半径X<M<Z<Y B. 非金属性X <M<Z<Y
C. X、Y、Z三种元素组成的化合物的水溶液一定呈酸性 D. MZ2可用于自来水的杀菌消毒
查看答案和解析>>
科目: 来源: 题型:
【题目】若NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,18g的D2O含有的中子数、电子数均为10NA
B. 1.0 mol/L的FeCl3溶液中Fe3+的个数小于NA
C. 标准状况下,2.24 L甲醛中碳氢键的数目为0.2NA
D. 密闭容器中,加入2molHI,发生反应:2HI(g) ![]() H2(g)+I2(g),达到平衡后气体分子总数小于2NA
H2(g)+I2(g),达到平衡后气体分子总数小于2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】港珠澳大桥水泥的使用量约198万吨。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
下列叙述正确的是
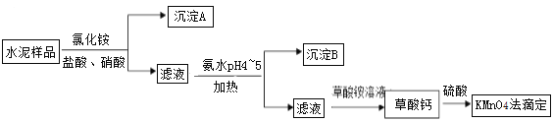
A. 水泥、玻璃、陶瓷为传统的硅酸盐材料,三者的原料都主要为SiO2
B. 沉淀A主要成分为SiO2,沉淀B为Fe(OH)3、Al(OH)3
C. 为了加快溶解速率,使用盐酸代替硫酸处理草酸钙
D. 草酸钙易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com