
科目: 来源: 题型:
【题目】某溶液溶质的质量分数为10%,下面说法正确的是( )
①在100份质量溶液中含有10份质量溶质;②在110份质量溶液中含有10份质量溶质;
③在100份质量溶剂中含有10份质量溶质;④在90份质量溶剂中溶有10份质量溶质。
A. ①② B. ③④ C. ②③ D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下进行反应2X(g)+Y(g)![]() Z(s)+3W(g) ΔH<0。达到平衡后,t1时刻改变某一条件所得vt图像如图,则改变的条件为( )
Z(s)+3W(g) ΔH<0。达到平衡后,t1时刻改变某一条件所得vt图像如图,则改变的条件为( )

A. 增大压强B. 升高温度C. 加催化剂D. 增大生成物浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g)。经5 min时测得D的浓度为1 mol·L-1,c(A):c(B)=3:5,C的平均反应速率是0.3 mol·L-1·min-1,求
(1)x值是多少? ___________
(2)5 min 时A的物质的量为多少?_____________
(3)B的平均反应速率为多少?___________
(4)B的转化率为多少?____________
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
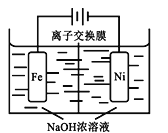
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。

Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。
(1)写出该反应的离子方程式 ___________________________________________________;为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是______________;除如图所示的实验用品、仪器外,还需要的一件实验仪器是__________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________________。
(3)试简述测定该反应的化学反应速率的其他方法:_______________________________________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(4)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和______探究温度对该反应速率的影响; (Ⅲ)实验①和______探究大理石规格(粗、细)对该反应速率的影响。 |
② | _______ | 粗颗粒 | ______ | |
③ | ____ | ___ | 2.00 | |
④ | 298 | ________ | _____ |
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g) + O2(g)![]() 2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是

A.a<0
B.过程II可能使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.反应物断键吸收能量之和小于生成物成键释放能量之和
查看答案和解析>>
科目: 来源: 题型:
【题目】在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
A.混合气体的压强B.混合气体的平均相对分子质量
C.A的物质的量D.B的物质的量浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】锌锰干电池是很古老的一次性电池,它的生产原料主要有软锰矿和闪锌矿。已知闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分;软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分。科研人员开发了综合利用软锰矿和闪锌矿的同槽酸浸工艺,工艺流程如下图所示。
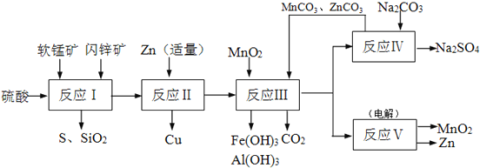
请回答下列问题:
(1)反应I需不断搅拌,目的是____________________________。
(2)检验反应I的滤液中含有Fe3+的试剂为____________;写出反应I中由FeS生成Fe3+的离子方程式____________________________________。
(3)反应Ⅱ加入适量锌的作用是__________________;反应III中MnO2的作用是________________。
(4)已知ZnCO3、MnCO3的Ksp分别为1.4×10-10、2.2×10-11;要使反应IV之后的溶液中Zn2+、Mn2+浓度均降到1.0×10-6mol/L,则溶液中残留的CO32-浓度至少为__________mol/L。
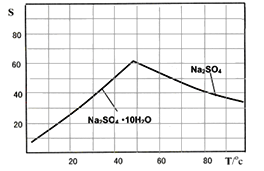
(5)图是Na2SO4和Na2SO410H2O的溶解 度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液________→__________→ 用乙醇洗涤→干燥。用乙醇洗涤而不用水洗的原因是_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
![]()
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com