
科目: 来源: 题型:
【题目】高锰酸钾是一种重要的化工原料,其绿色化制备是重要的课题。某课外小组设计如下方案用锰酸钾制备高锰酸钾。
I. 锰酸钾制备。将二氧化锰、氯酸钾和氢氧化钾固体放入铁坩埚熔融制锰酸钾。
(1)搅拌时用___________(填“铁棒”或“玻璃棒”)。
(2)若要制得锰酸钾59.1g,至少需要氯酸钾___________g。
II. 高锰酸钾制备。制备高锰酸钾的装置如下图所示(加热与夹持装置省略)。
用I制得的锰酸钾加少量蒸馏水溶解,得墨绿色溶液,倒入三颈瓶中。打开甲装置分液漏斗活塞加入稀硫酸,加热,生成乙酸蒸气,通入乙装置,水浴加热,搅拌,锰酸钾在酸性条件反应生成高锰酸钾和二氧化锰。

(3)用离子方程式表示甲装置中存在的化学平衡___________(任写一个)。
(4)乙装置中发生反应的化学方程式:______________________。
(5)丙装置中氢氧化钠溶液的作用是______________________。
(6)甲装置容易发生倒吸,改进的措施是______________________。
(7)判断乙装置中锰酸钾完全反应的实验方法是;用玻璃棒蘸取溶液滴到滤纸上,若观察到______________________, 表示锰酸钾已完全反应。
III.高锰酸钾产品的纯度分析。
(8)将乙中所得溶液过滤,把滤液倒入蒸发皿中,浓缩,冷却,抽滤,洗涤,干燥得KMnO4产品。请设计实验证明产品中含有少量MnO2:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣A组的同学们利用废硫酸溶液制备K2SO4晶体,设计流程如下图所示:
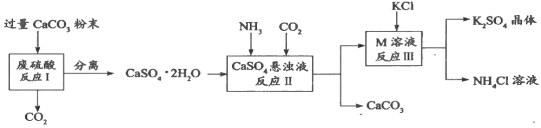
(1)写出反应Ⅰ的化学方程式:______________________。
(2)反应Ⅱ生成了一种可用作肥料的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是_________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是_____________;为了检验此晶体是否洗涤干净,取最后一次洗涤液于试管中,先加入过量的_______(选填字母),振荡、静置, 再向上层清液中滴加_______(选填字母),观察现象即可判断该晶体是否洗涤干净。
A. AgNO3溶液 B. BaCl2溶液 C. Ba(NO3)2溶液 D .Ba(OH)2溶液 E. NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于________(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是________(填字母)。
a. 陶瓷 b. 水泥 c. 玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x,y的数值分别是________(填字母)。
a. 5、4 b. 6、3 c. 7、2
④下列物品的构成材料中主要是合成高分子材料的是________(填字母)。
a. 宣纸 b. 羊毛衫 c. 保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是________结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)某品牌果冻标签如图所示。回答下列问题:

①食品添加剂中,属于无机盐的是______(填化学式)。
②属于着色剂的是诱惑红和______;属于防腐剂的是______。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式______。
(3)化学与科学技术、生产生活及环境保护等密切相关。
①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是______;严格整治畜禽养殖场污染,主要是为减少______和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式____________________________________________________。
③阿司匹林作为一种药物,主要具有______作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2 ·H2O等物质的化学方程式___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米微晶碱式碳酸锌是一种新型的碱式碳酸锌,在医药行业可用作皮肤保护剂,在化妆品生产中用作基础原料。用工业级硫酸锌(主要成分ZnSO4·7H2O,含少量Fe2+、Cu2+、Cd2+、Co2+、Ni2+)制备纳米微晶碱式碳酸锌[ Zn4CO3(OH)6]的一种流程如下:
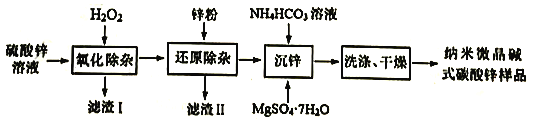
回答下列问题:
(1)配制硫酸锌溶液:①烧杯中加入100g工业级硫酸锌;②加入116mL的蒸馏水,用玻璃棒搅拌,直至完全溶解,得160mL溶液。配制时还需用到的玻璃仪器是___________,所得ZnSO4溶液的物质的量浓度约为___________。(已知ZnSO·7H2O的摩尔质量为287g·mol-1)
(2)“氧化除杂”是除去溶液中Fe2+
①滤渣I的主要成分是___________(填化学式)。
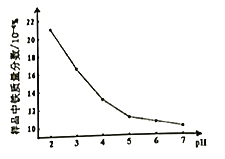
②控制其它条件不变,溶液的pH对H2O2除铁效果的影响如图,除铁时应控制溶液pH为___________(填整数值)。(已知:ksp[Zn(OH)2]=1.2×10-17,溶液体积变化忽略不计)
(3)“还原除杂”。除Cu2+、Cd2+后,再加入Zn粉和少量Sb2S3,形成锑锌微电池,提高除Co2+、Ni2+的反应速率。则Zn2+、Co2+、Sb3+的氧化性强弱顺序:___________>___________>___________(填离子符号)。_______________
(4)“沉锌时,①生成纳米微晶碱式碳酸锌的离子方程式为______________________。
②加入MgSO4·7H2O的目的主要是降低所得粉体的晶粒度,但也要保证主元素的质量分数在56%以上。下表是不同Mg:Zn(质量比)对产品品粒度及Zn质量分数的影响:
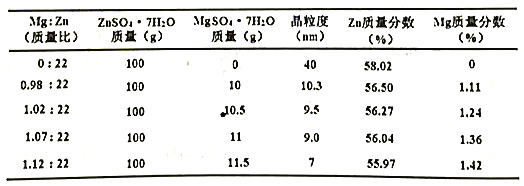
Mg︰Zn(质量比)不宜超过______________________。
(5)用EDTA滴定法测样品中锌的含量,反应式为Zn2++H2Y2-=ZnY2-+2H+。取a g纳米微晶碱式碳酸锌样品,在pH为5~6的乙酸-乙酸钠缓冲溶液中,以二甲酚橙作指示剂,用 b mol· L-1EDTA(H2Y2-)标准溶液滴定,消耗EDTA溶液c mL则样品中锌的质量分数是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件己略去)。A是由两种元素组成的难溶于水的物质,摩尔质量为88 g·mol-l;B是常见的强酸;C是一种气态氢化物;气体E能使带火星的木条复燃;F是最常见的无色液体;无色气体G能使品红溶液褪色;向含有I的溶液中滴加KSCN试剂,溶液出现血红色。请回答下列问题:

(1)G的化学式为_________________________。
(2)C的电子式为________________________。
(3)写出反应①的离子方程式:_____________________。
(4)写出反应②的化学方程式:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论正确的是( )
A. X中有两种溶质
B. Y通入纯水中得到酸性溶液
C. 原混合粉末的总质量小于7.8 g
D. 当V=1 680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业以浓缩海水为原料提取溴的部分过程如下:

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)_________。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是_________。
(3)反应过程中,B装置中Br2与SO2反应的化学方程式____________________。
(4)C装置的作用是___________________。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用____________________方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是________。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由: _______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 锌与CH3COOH溶液反应:Zn+2H+===Zn2++H2↑
B. 氢氧化铝与稀硝酸反应:H++OH-===H2O
C. CuCl2溶液与铁粉反应:3Cu2++2Fe===3Cu+2Fe3+
D. MgCl2溶液与氨水反应:Mg2++2NH3·H2O===Mg(OH)2↓+2NH![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是重要的基本化工原料,以乙烷为原料生产乙烯有多种方法。
I.乙烷裂解脱氢法。该方法的反应为:C2H6(g)=C2H4(g)+H2(g) △H= a kJ·mol-1
(1)已知101kPa,298K时,C(s)和H2(g)生成lmoC2H6(g)、1molC2H4(g)的△H分别为-84.7 kJ·mol-1、+52.3 kJ·mol-1。则a=___________。
II.乙烧氧化脱氢法,在原料气中加入氧气,乙烷氧化脱氢的反应如下:
2C2H6(g)+O2(g)![]() 2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
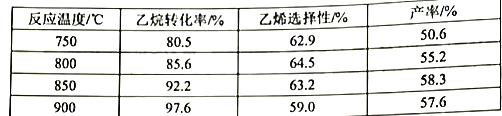
(2)①反应的平衡常数表达式为K=___________,K(750℃)___________K(900℃)(填“>”、“<”、“=”)
②当温度超过800℃时,乙烯的选择性降低,其主要原因可能是___________。根据表中数据选择适宜的反应温度为___________。
III.催化氧化脱氢法。以Mo-V-Nb-Sb的氧化物为催化剂,在常压、380℃下,反应速率与氧气分压[P(O2)]、乙烷分压[P(C2H6)的关系如下图所示。
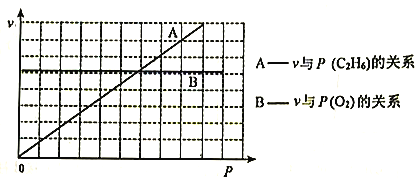
(3)已知该反应的速率方程为v=kPm(O2)·Pn(C2H6),则m=___________,n=___________。
IV质子膜燃料电池法。
(4)乙烷氧化制乙烯会产生CO2的大量排放,近年研究人员开发了乙烷氧化制乙烯的质子膜燃料电池(SOFC),该燃料电池的负极反应式为______________________,这种电池工作过程中没有CO2排放,原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com