
科目: 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关原子的说法正确的是
①原子是由核外电子和原子核构成的 ②原子不能再分 ③原子是化学变化中最小的粒子 ④原子的质量主要集中在原子核上
A.①②B.①③④C.①②③D.①③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论或解释 |
A | 向盛有漂白粉溶液的试管中加入浓硫酸 | 产生黄绿色气体 | 浓硫酸具有氧化性 |
B | 向SO2 水溶液中滴入几滴BaCl2溶液,振荡 | 出现白色沉淀 | 此沉淀是BaSO3 |
C | 使装有NO2 气体的密闭容器减小体积 | 气体颜色先变深而后变浅 | 气体颜色变浅的原因是2NO2 =N2O4 正向移动 |
D | 先向2mL0.1mol/LNa2S 溶液中滴入几滴0.1mol/LZnSO4 溶液,再加入几滴CuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | 溶度积Ksp:ZnS>CuS |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。

起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1) /℃ | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 _________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________温度。
(4)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(5)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ ) (保留两位小数)。
(6)如果用50 mL0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,则△H会_________(填“偏大”、“偏小”、“无影响”),其原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
![]()
环己醇
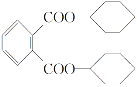
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】酸雨形成的原理之一可表示如下:
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题。
(1)A的化学式为__________,B的化学式为__________________________________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)雨水的pH小于5.6时,就判定为酸雨。已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香族化合物X和Y都是从樟脑科植物中提取的香料。X可按如图路线合成Y。

已知:①RCH-CHR’![]() RCHO+R’CHO
RCHO+R’CHO
②不含α-氢原子(与醛基直接相连的碳上的氢)的醛在浓碱作用下醛分子自身同时发生氧化与还原反应,生成相应的羧酸(在碱溶液中生成羧酸盐)和醇的反应。
如:2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
(1)X的官能团名称为___________。
(2)Y的结构简式为___________。
(3)D+G→Y的有机反应类型为___________。
(4)下列物质不能与D反应的是___________(选填序号)
a.金属钠 b.氢溴酸 c.碳酸钠溶液 d.乙酸
(5)写出下列反应方程式:X→G的第①步反应_____________________________。E→F___________________________________。
(6)G有多种同分异构体,写出同时满足下列条件的G的所有同分异构体的结构简式______________(不考虑空间立体异构)。
i.能发生银镜反应 ⅱ.能发生水解反应 ⅲ.苯环上只有一个取代基
(7)G的另一种同分异构体H的结构简式为![]() 下,写出以
下,写出以![]() 为有机原料,制取H的合成路线(可任选无机原料)
为有机原料,制取H的合成路线(可任选无机原料) ![]() →___________。
→___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、镁、金等的相关物质在生产生活中具有重要的作用。回答下列问题:
(1)铜元素在周期表中的位置是___________,基态铜原子中,核外电子占据最高能层的符号是___________,占据该最高能层的电子数为___________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、 Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___________(填“晶体”或“非晶体”)
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,lmol(SCN)2分子中含有σ键的数目为___________。(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种。理论上前者沸点低于后者,其原因是____________________________________________。
(4)铜与金形成的金属互化物的晶胞结构如图1所示,其晶胞边长为anm,该金属互化物的密度为___________(用含a、NA的代数式表示)g·cm-3。

(6)某金属晶体中原子的堆积方式为六方最密堆积如图2所示,晶胞可用图3表示。已知该金属的原子半径为acm,该金属晶胞的高为bcm:若以晶胞中A点原子为原点建立空间直角坐标系o-xyz,则A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com