
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol![]() 含中子数为8NA
含中子数为8NA
B. 常温下,1 mol NH4Cl含共价键数目为5NA
C. 足量的Cu与含溶质1mol的浓H2SO4反应,转移的电子数为NA
D. 标况下,22.4LNO和11.2LO2混合后的气体分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】有机高分子材料M的结构简式为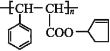 ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
已知:①A分子中有两种不同环境的氢原子
②CH3CH2CH![]() CH2
CH2![]() CH3CHBrCH
CH3CHBrCH![]() CH2
CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH
CH3CH![]() CHCHO+H2O
CHCHO+H2O
请回答以下问题:
(1)A的结构简式为____,B的名称为____,F中所含官能团的名称是__________。
(2)①和③的反应类型分别是____、____;反应②的反应条件为_____________。
(3)反应④的化学方程式为_____________________________________________。
(4)有机物E有多种同分异构体,其中同时符合下列条件的同分异构体有___种。
①属于芳香酯类 ②其酸性水解产物遇FeCl3显紫色
(5)以1-丙醇和NBS为原料可以制备聚丙烯醇(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
A![]() B……
B……![]() 目标产物
目标产物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.乙酸的沸点比乙醇的高
B.乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸
C.乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应
D.乙酸分子中虽然有4个氢原子,但乙酸是一元酸
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F、G7种物质的转化关系如下:
(1)A+B→C+H2O (2)C+KOH→D↓(蓝色)+E
(3) B+D→C+H2O (4)E+BaCl2→KCl + F↓(白色,不溶于稀硝酸)
(5)G+B→CO2↑+F↓+H2O,反应中B与CO2的物质的量之比为1:2
根据上述变化关系填空:
(1)请写出下列物质的化学式:B___;C___;F___;G___。
(2)检验E中的阴离子的实验是___。
(3)往G的溶液中滴加过量的KOH,反应的离子方程式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知,25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2C2O4 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=5.9×10-2,K2=6.4×10-6 |
下列有关说法正确的是( )
A. CH3COOH溶液与Na2CO3反应生成CO2可以证明乙酸是弱酸
B. H2C2O4溶液的电离方程式为 H2C2O4![]() 2H+ + C2O42-
2H+ + C2O42-
C. 加水稀释HCN溶液,促进HCN的电离且c(CN-)/c(OH-)增大
D. 在Na2C2O4 溶液中加入足量的CH3COOH溶液发生反应的离子方程式为 C2O42- + CH3COOH=CH3COO- + HC2O4-
查看答案和解析>>
科目: 来源: 题型:
【题目】以铁片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2mol电子时,下列说法正确的是( )
A. 铁片溶解1 mol,铜片上析出1 mol H2
B. 两极上溶解和析出的物质的质量相等
C. 铁片溶解2 g,铜片上析出1 g H2
D. 铁片溶解1 mol,转移电子1 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种 浓度之和的分数)与pH的关系分别如图所示。
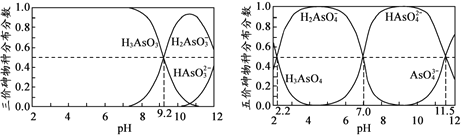
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 _____________________。 ②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应的ΔH________0(填“>”或“<”)。
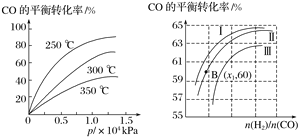
图表示CO的平衡转化率与起始投料比、温度的变化关系,测得B(x1,60)点氢气的转化率为40%,则x1=__________。
②一定条件下,将2 mol CO和2 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去)。
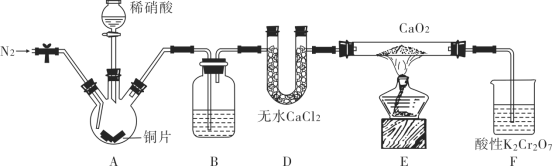
已知:2NO+CaO2=Ca(NO2)2 ;2NO2+CaO2=Ca(NO3)2 。
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因是_____________。
(2)仪器D的名称是______________;B中盛装的试剂是__________。
(3)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO![]() ,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为____________________________________________________________。
,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为____________________________________________________________。
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体。设计实验证明E中有亚硝酸钙生成_____________________________________________________________。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO+NO2=Ca(NO2)2+H2O。
①若n(NO)∶n(NO2)>1∶1,则会导致______________________________________________;
②若n(NO)∶n(NO2)<1∶1,则会导致______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向某恒容密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是
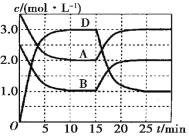
A. 反应在前10min内的平均反应速率v(D)=0.15mol·L-1·min-1
B. 该反应的平衡常数表达式为K= ![]()
C. 若平衡时保持温度不变,压缩容器容积,则平衡向逆反应方向移动
D. 反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A![]() C由两步反应A→B→C构成,1molA发生反应的能量曲线如图所示。下列有关叙述正确的是
C由两步反应A→B→C构成,1molA发生反应的能量曲线如图所示。下列有关叙述正确的是
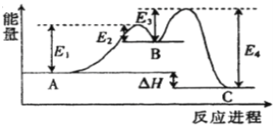
A. A![]() C的正反应为吸热反应
C的正反应为吸热反应
B. 加入催化剂会改变A与C的能量差
C. A![]() C正反应的活化能大于其逆反应的活化能
C正反应的活化能大于其逆反应的活化能
D. A![]() C的反应热△H=E1+E3-E2-E4
C的反应热△H=E1+E3-E2-E4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com