
科目: 来源: 题型:
【题目】实验室制备硝基苯实验装置和步骤如下:
(实验步骤)
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。

将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝酸基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)配制混合液时,_____(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由_________。
(4)为了使反应在50~60 ℃下进行,常用的方法是__________。
(5)在洗涤操作中,第二次水洗的作用是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】哈尔滨医科大学附属第一医院张亭栋教授被认为最有可能获诺贝尔生理学或医学奖的学者之一,他是使用砒霜(As2O3)治疗白血病的奠基人,回答下列问题:
(1)基态As原子核外电子排布中能级最高的是___________,与As同周期且相邻原子的第一电离能由大到小的顺序为___________。
(2)NH3的沸点比PH3___________(填“高”或“低”),原因是___________。
(3)NH5中所有原子最外层都满足稳定结构,则NH5中含有的化学键类型为___________。
A、离子键 B、配位键 C、共价键 D、氢键 E、σ键 F、π键
(4)As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。与AsO43-互为等电子体的微粒是___________(写一种)
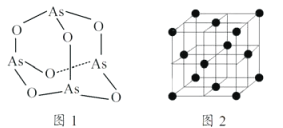
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小黑点表示白磷分子),已知晶胞的边长为anm,阿伏加德罗常数为 NAmol-1,则该晶胞中含有的P4分子数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:
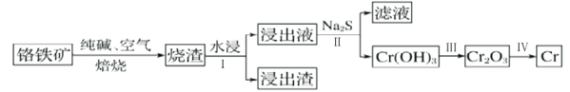
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。
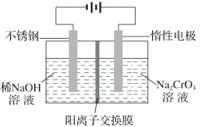
①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图两套基础实验装置回答问题。

(1)写出下列仪器的名称:______________、___________________。
(2)仪器①~④中,使用时必须检查是否漏水的有____________________。(填序号)
(3)用装置I制蒸馏水,还缺少的仪器有_________,冷却水从_______口进。
(4)a.现需配制250mL0.2molL-1NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是_______________,_______________。
b.配制过程中,下列情况会使配制结果偏高的是________________(填序号)。
①定容时俯视刻度线观察液面;②容量瓶使用时未干燥;③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;④移液时未洗涤烧杯和玻璃棒
c.若实验中加蒸馏水时不慎超过了刻度,应如何处理?______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
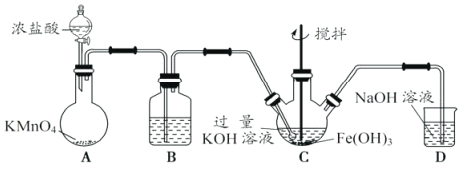
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
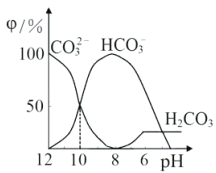
A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,无水LiCl-KCl混合物受热熔融后,电池即可瞬间输岀电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是
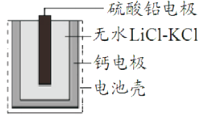
A. 放电时,电子由Ca电极流出
B. 放电时,Li+向PbSO4电极移动
C. 负极反应式:PbSO4+2e-+Li+=Li2SO4+Pb
D. 每转移0.2mol电子,理论上生成还原产物Pb的质量为20.7g
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。
(1)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br- → Br2转化的目的是_____,吸收塔中发生反应的离子方程式是________,
②从MgCl2溶液中得到MgCl2.6H2O晶体的主要操作是__________、_________、过滤、洗涤、干燥。
(2)![]()
①灼烧过程中用到的实验仪器有铁三角架、酒精灯、坩埚钳、_____、______。
②操作①中需用到玻璃棒,则玻璃棒的作用是_______________。
③向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________。
④操作③是分液,则操作②是___________;操作④是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列食品添加剂与类别对应正确的一组是( )
A.着色剂——靛蓝、苯甲酸钠B.增味剂——亚硝酸钠 、味精
C.防腐剂——氯化钠、柠檬黄D.营养强化剂——酱油中加铁元素、粮食制品中加赖氨酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com