
科目: 来源: 题型:
【题目】在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2![]() N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
A. ②④ B. ③④ C. ③⑤ D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】I.现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图 1 所示),并测定电离平衡常数 Kb。

(1)实验室可用浓氨水和X 固体制取 NH3,X 固体可以是_____。
A.生石灰 B.无水氯化钙 C.五氧化二磷 D.碱石灰
(2)检验三颈瓶集满NH3 的方法是:_____。
(3)关闭 a,将带有装满水的胶头滴管的橡皮塞塞紧 c 口,_________,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图 2 所示。图 2 中_____点时喷泉最剧烈。
(4)量取收集到的氨水 20.00 mL,测得 pH=11.0。不断滴加 0.05000 mol/L 盐酸,当盐酸体积为22.50 mL 时恰好完全反应。计算 NH3H2O 电离平衡常数 Kb 的近似值,Kb ≈_____。
II.已知 1 mol SO2(g)氧化为 1 mol SO3 的ΔH= -99kJ·mol-1 请回答下列问题:
(1)已知单质硫的燃烧热为 296 kJ·mol-1,计算由 S(s)生成 3 mol SO3(g)的 ΔH =_____。
(2)在量热计中(如图)将 100 mL 0.50 mol/L 的 CH3COOH 溶液与100 mL 0.55 mol/L NaOH 溶液混合,温度从 298.0 K 升高到 300.7 K。已知量热计的热容常数(量热计各部件每升高 1 K 所需要的热量)是150.5 J/K,溶液密度均为 1 g/mL,生成溶液的比热容c=4.184 J/(g·K)。则 CH3COOH 的中和热ΔH=_____。

(3)CH3COOH 的中和热的文献值为-56.1 kJ/mol,你认为(1)中测得的实验值偏差可能的原因是(填二点)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中的氯离子浓度与50mL 1 mol/L的AlCl3溶液中氯离子浓度相等的是
A. 150mL 3 mol/L的KClB. 75mL 2 mol/L的NH4Cl
C. 150mL 1 mol/L的NaClD. 75mL 2 mol/L的CaCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH 溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
(1)常温下,在 pH = 5 的稀醋酸溶液中,c(CH3COO-)=_____(不必化简)。下列方法中,可以使 0.10 mol·L-1 CH3COOH 的电离程度增大的是_____
a.加入少量 0.10 mol·L-1 的稀盐酸 b.加热 CH3COOH 溶液
c.加水稀释至 0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量 0.10 mol·L-1 的 NaOH 溶液
(2)将等质量的锌投入等体积且 pH 均等于 3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_____V(醋酸),反应的最初速率为:υ(盐酸)_____υ(醋酸)。(填写“>”、“<”或“=”)
(3)已知:90℃时,水的离子积常数为 Kw=3.8×10-13,在此温度下,将 pH=3 的盐酸和 pH=11 的氢氧化钠溶液等体积混合,则混合溶液中的 c(H+)=_____mol/L(保留三位有效数字)。
Ⅱ.(1)常温下,已知 0.1 mol·L-1 一元酸HA 溶液中c(OH-)/c(H+)=1×10-8。常温下,0.1mol·L-1 HA溶液的 pH=_____;
(2)常温下,向 pH=a 的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的 pH_____(14-a)(填写“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 2A(g)+B(g) 2C(g) ΔH= -a kJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入 2 mol A 和 1 mol B,在 500 ℃时充分反应达到平衡后C 的浓度为 x mol·L-1,放出热量bkJ。请回答下列问题:
(1) a_____b(填“>”、“=”或“ <”)。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中 T1_____ T2(填“>”、“< ”或“ =”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.54×105 | 1.88×103 |
若在原来的容器中,只加入 2 mol C,500 ℃时充分反应达到平衡后,吸收热量 c kJ,则 C 的浓度_____x mol·L-1(填“>”、“=” 或“ <”),a、b、c 之间满足何种关系?_____(用代数式表示)
(3)在相同条件下要想得到 2a kJ 热量,加入各物质的物质的量可能是_____(填字母)。
A.4 mol A 和 2 mol B B.4 molA、2 mol B 和 2 mol C
C.4 mol A 和 4 mol B D.6 molA 和 4 mol B
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____(填字母)。
A.及时分离出C 气体 B.适当升高温度 C.增大 B 的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入 2 mol A 和 1 mol B,500 ℃时充分反应达到平衡后,放出热量 d kJ,则 d_____b(填“>”、“=” 或“ <”),理由是_____。
(6)在一定温度下,在一个容积不变的容器中通入 2 mol A 和 1 mol B 及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为 4 mol A 和 2 mol B,则平衡时A 的转化率_____(填“不变”、“变大”、“变小”或“不能确定”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO![]() 、Ba2+、SO
、Ba2+、SO![]() 。现取3份该溶液各100 mL分别进行如下实验:
。现取3份该溶液各100 mL分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体,在标准状况下体积为2.24 L |
③ | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为12.54 g,第二次称量读数为4.66g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________(填“一定存在”“一定不存在”或“不能确定”);根据实验①~③判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol/L) |
__________ | |
(3)试确定K+是否存在 __________ (填“是”或“否”),判断的理是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是重要的基本化工原料,广泛用于化学、冶金、造纸、纺织、医药、石油等工业,以及饮用水消毒、污水处理等方面。
(1)实验室制取Cl2的反应方程式为:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为_________;
Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为_________;
(2)KMnO4和盐酸反应也可制取Cl2:
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O
请配平该反应方程式。当标准状况下有11.2L氯气生成时,该反应转移电子的数目为_____。
(3)用氯氧化法可处理含KCN的废水。液氯在碱性条件下可以将氰化物氧化成毒性仅为氰化物的千分之一的氰酸盐,氰酸盐再进一步被氧化为无毒物质。
①由反应KCN+2KOH+Cl2 = KOCN + 2KCl+H2O判断,氰酸盐KOCN中C元素的化合价为_________(已知反应前后氮元素化合价未改变);
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移的方向和数目:
2KOCN+4KOH+ 3Cl2 = 2CO2↑ + N2 ↑+6KCl + 2H2O
______________________________
③若某厂废水中含KCN的浓度为0.65g/L,处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯的物质的量为___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物丙属于桥环化合物,是一种医药中间体,可以通过以下反应制得:
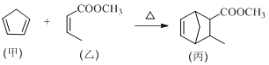
下列有关说法正确的是
A. 甲分子中所有原子可能处于同一平面上
B. 乙可与H2按物质的量之比1∶2发生加成反应
C. 丙能使酸性高锰酸钾溶液、溴的CCl4溶液褪色,且原理相同
D. 等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其合金是生活中常见的材料,下列说法错误的是
A.铜制品表面的铜绿主要成分是CuCO3
B.生铁、碳素钢、合金钢中都含碳元素
C.合金的熔点可以低于它的成分金属
D.目前我国流通的硬币是用合金材料铸造的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com