
科目: 来源: 题型:
【题目】水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母编号,可多选)。

(2)下图是某市污水处理的工艺流程示意图:

①下列物质中不可以作为混凝剂(沉降剂)使用的是______(填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母编号)。
A.物理变化 B.化学变化
C既有物理变化又有化学变化
(3)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2===KOCN+2KCl+H2O再投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式:
___KOCN+___KOH+___Cl2―→___CO2+___N2+___KCl+___H2O。若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素W的原子结构示意图为![]() ,下列说法不正确的是
,下列说法不正确的是
A. W处于元素周期表的第三周期
B. m=7,W形成的单质可用于自来水消毒
C. m=1,W的最高价氧化物对应的水化物是一种弱碱
D. m=6,W可以形成化学式为WO2的氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】卤块的主要成分是MgCl2,还含有少量SiO2。现以卤块为原料按如图所示流程进行生产,用于制备金属镁。

请回答下列问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施是____________(任写一条)。
(2)步骤②得到的X是___(填化学式),能够分离得到沉淀的方法是_____
(3)写出步骤④的化学方程式:_______
(4)步骤①中溶解卤块的盐酸如果过量太多造成的影响是____
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用粗锌(杂质难溶于水且不与酸反应)与100g稀硫酸反应时,实验数据如下表所示:
实验序号 | 粗锌质量/g | 稀硫酸质量/g | 生成气体质量/g | 反应后剩余固体质量/g |
实验1 | 8 | 100 | 0.2 | 1.5 |
实验2 | 16 | 100 | 0.4 | 3 |
实验3 | 30 | 100 | 0.6 | 10.5 |
(1)实验中稀硫酸反应完的是______(填实验序号);
(2)计算稀硫酸的溶质质量分数______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为实验室中常见的气体制备、干燥和性质实验的部分仪器。

请回答下列问题:
(1)若实验室用大理石和稀盐酸反应制取并收集一瓶干燥的二氧化碳。
①所选仪器的连接顺序为______________________________(填写仪器序号字母)。
②生成二氧化碳的化学方程式为:____________________________。
(2)现有一混合气体,其主要成分为CO,含有少量水蒸气,还可能含有少量HCl气体。某化学课题组的同学欲用该混合气体进行实验:①检验HCl气体是否存在,并除去HCl气体②用干燥纯净的CO气体还原不纯的氧化铜试样(其中的杂质不发生变化)③检验CO气体还原氧化铜生成的气体生成物的性质。试用如图所示的仪器组装一套实验装置,完成上述实验任务。
①实验进行时,若要气体从左向右流动,则这几种仪器组件的连接顺序应是(填写仪器装置):_________。
②判定HCl气体是否存在的根据是___________________。
③若反应进行完全后,若仪器E中物质增重a g,则仪器D中的试样质量减少____g。
④若原混合气体中混有二氧化碳,反应进行完全后,若通过仪器E中物质增重来计算样品中氧化铜的纯度,测算结果将____(填“偏小”“偏大”“不受影响”之一)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用化学用语表示:
(1)2个铜离子__________;
(2)氧化铁中铁元素的化合价为+3价_______;
(3)溶于水温度降低的一种盐_________;
查看答案和解析>>
科目: 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
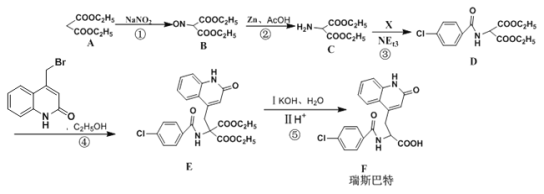
已知:Y的结构简式为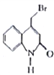 。
。
(1)A的化学名称为___________,化合物F的分子式为___________。
(2)化合物C中官能团的名称为___________,C与足量的NaOH溶液反应的化学方程式为___________。
(3)反应①~④中,属于取代反应的是___________(填序号)。
(4)C→D的转化中,生成的另一种产物为HCl,则X的结构简式为___________。
(5)已知Y中的溴原子被-OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:___________
I.分子中含有一个苯环和一个五元环,且都是碳原子形成环;
I1.苯环上有两个取代基,且处于对位;
Ⅲ.能与 NaHCO3溶液发生反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛一铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的价电子排布图为___________。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为___________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要___________(填“高”“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯三甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有___________个π键。
②在丙醛( CH3CH2CHO)分子中碳原子的杂化方式分别为___________。
③C、N、O、Ne四元素,其第一电离能从大到小的顺序依次为______________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与VO43-空间构型相同的一种阴离子:___________(填离子符号)。
(4)已知单质钒的晶体采用体心立方堆积,晶胞如上图4所示,假设钒原子直径为d×10-7cm,钒的相对原子质量为M,则晶体密度的表达式为___________g·cm-3。(设阿伏加德罗常数为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com