
科目: 来源: 题型:
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是___________(填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数___________(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中水电离出来的c(H+)_________(填“大于”、“等于”或“小于”)醋酸溶液水电离出来的c(H+)。

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______________________(填准确数值)。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=_____________________。(用含“ c、a的代数式表示”)
查看答案和解析>>
科目: 来源: 题型:
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察下图(左),标准液盐酸应放入___________滴定管中。(填“甲”或“乙”)


(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__________________________________,滴定终点的现象为_______________。
(3)若滴定开始和结束时,酸式滴定管中的液面如上图(右)所示,则起始读数为___________mL,所用盐酸溶液的体积为___________________mL。
(4)某学生根据3次实验分别记录有关数据如表所示:

依据表中数据计算该NaOH溶液的物质的量浓度________________。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
化学键 | N≡O (NO) | Cl-Cl | Cl-N | N=O |
键能/(kJ/mol) | 630 | 243 | a | 607 |
则反应2NO(g)+Cl2(g)2ClNO(g)的ΔH和a的关系为ΔH= _______________kJ/mol。
(3)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
n=________________;k=__________________________。
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是______________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目: 来源: 题型:
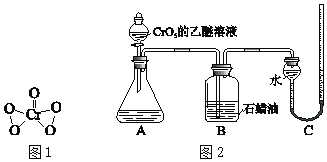
【题目】实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。
(实验Ⅰ)向盛有H2O2溶液的试管中,加入过量的K2Cr2O7溶液和硫酸,振荡,溶液立即变为紫红色,此时pH=1.溶液中持续产生气泡,最终溶液变为绿色。
资料:
ⅰ.Cr2(SO4)3溶液呈绿色。
ⅱ.酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2。
ⅲ.CrO5是一种+6价Cr的过氧化物,其结构如图1,CrO5可溶于水,易溶于乙醚得到蓝色溶液。
ⅳ.乙醚是一种无色、不溶于水、密度比水小的有机溶剂,化学性质稳定。
(1)实验Ⅰ中产生的气体是O2,检验的方法是___________。
(2)实验Ⅰ的紫红色溶液中含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是_________________。
②生成CrO5的反应不是氧化还原反应,反应的离子方程式是_______________。
(3)对实验Ⅰ中溶液变为绿色和产生O2的原因,作出如下假设:
a.CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。
b.CrO5在酸性条件下氧化了溶液中的H2O2,生成Cr3+和O2。
为验证上述假设,用图2装置进行实验Ⅱ和实验Ⅲ(夹持装置已略,B中石蜡油用于吸收挥发出的乙醚)。实验操作及现象如下:
(实验Ⅱ)
ⅰ.将20mL CrO5的乙醚溶液加入A中的20mLpH=1的稀硫酸中,不断搅拌,乙醚层由蓝色变为无色,水层变为绿色,O2体积为V mL。
ⅱ.步骤ⅰ结束后向A中加入少量K2Cr2O7溶液,轻轻搅拌,静置,乙醚层又显出蓝色。
(实验Ⅲ)
仅将实验Ⅱ中的pH=1的稀硫酸替换为等量的含H2O2的pH=1的稀硫酸,重复实验。现象与实验Ⅱ相同,且O2体积仍为V mL。
①实验Ⅱ步骤ⅰ中消耗的CrO5与生成的O2的物质的量之比为2:3,补全离子方程式:2CrO5+____=2Cr3++3O2↑+_____+_____。
②甲同学认为依据实验Ⅱ和Ⅲ中生成O2的体积相同,无法说明假设b是否成立,其理由是_________。
(4)实验Ⅰ中总反应的离子方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示。

(1)若以A点表示25 ℃时水在电离平衡时的离子浓度,当温度升到100 ℃时,水的电离平衡状态到B点,则100 ℃时,水的离子积为______________。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100 ℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为_______________________。
(3)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_________________________,由水电离出的c(OH-)=_______________mol·L-1。
(4)等体积的下列溶液中,阴离子的总物质的量最大的是_____________(填序号)。
①0.1 mol·L-1的CuSO4溶液 ②0.1 mol·L-1的Na2CO3
③0.1 mol·L-1的KCl ④0.1 mol·L-1的NaHCO3
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-,HA-H++A2-。
①则Na2A溶液显__________(填“酸性”“中性”或“碱性”);NaHA溶液显__________(填“酸性”“中性”或“碱性”)。
②现有0.1 mol·L-1 Na2A的溶液,其中各种微粒浓度关系正确的是__________(填字母)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)
B.c(Na+)=2c(HA-)+2c((A2-)+2c(H2A)
C.c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D.c(OH-)=c(HA-)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是_____。
(2)Ⅰ中,生成K2MnO4的化学方程式是_____。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是_____。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是_____。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4.装置如图:
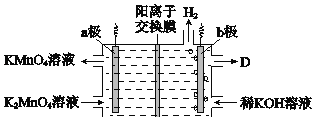
①b极是_____极(填“阳”或“阴”),D是____________。
②结合电极反应式简述生成KMnO4的原理:___________。
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是__________。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 +H2SO4 ═H2C2O4 +Na2SO4
5H2C2O4 +2MnO4﹣+6H+═2Mn2++10CO2↑+8H2O
摩尔质量:Na2C2O4 134g/mol KMnO4 158g/mol
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液V mL(杂质不参与反应)。
产品中KMnO4的质量分数的表达式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】防治雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(1)PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子(OH-忽略不计)的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度(mol/L) | 2.0×10-6 | 2.8×10-5 | 3.5×10-5 | 6.0×10-5 |
则试样的pH为________________________。
(2)一定条件下,以CO和H2合成清洁能源CH3OH,其热化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:

①该可逆反应的ΔH__________0(填“>”“<”或“=”)。A、B、C三点对应的平衡常数KA、KB、KC的大小关系是______________。压强:p1__________p2(填“>”“<”或“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v(正)___________v(逆)(填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_________(填字母)。
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2 mol CO和4 mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2 L,则在该条件下反应的平衡常数K为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com