
科目: 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

(1)反应的ΔH_______0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为_____________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4) 以0.001 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是________________。 ②温度T时反应的平衡常数K2____________________。
(3)温度T时反应达平衡后,将反应容器的容积扩大一倍。平衡向____________ (填“正反应”或“逆反应”)方向移动,判断理由是_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是( )
A. 向含1 mol Ca(HCO3)2的溶液中加入1 mol Na2O2
B. 向带有氧化膜的铝片中加入盐酸
C. 向漂白粉溶液中通入过量CO2
D. 向含1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述错误的是( )
A. CS2的结构式为:S=C=S
B. 6CO2+6H2O![]() C6H12O6+6O2,该变化中光能转变为化学能
C6H12O6+6O2,该变化中光能转变为化学能
C. CO2(g)+C(s)![]() 2CO(g)△H>0,△S>0,该反应常温下能自发进行
2CO(g)△H>0,△S>0,该反应常温下能自发进行
D. 可以用酸性高锰酸钾溶液来鉴别乙醇、乙酸和苯
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物与我们的生活息息相关。下列说法正确的是
A. 卤代烃C3H7Cl有三种同分异构体
B. 石油裂解的目的是为了提高轻质液体燃料的产量和质量
C. 棉花和合成纤维的主要成分都是纤维素
D. 结构简式如图所示的有机物能发生加成反应、取代反应、氧化反应

查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在一个10 L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=c(CO)c(H2)/c(H2O),请回答下列问题:
(1)该反应的化学方程式为______________________________;若温度升高, K增大,则该反应是___________ (填“吸热”或“放热”)反应。
(2)能判断该反应一定达到平衡状态的是___________(填字母序号)。
A.v正(H2O)=v逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗nmol H2的同时消耗nmol CO
D.容器中物质的总物质的量不随时间改变
(3)该反应的v(正)随时间变化的关系如图,在t2min时改变了某种条件,改变的条件可能是______、________。(写2条)

查看答案和解析>>
科目: 来源: 题型:
【题目】在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含有________mol Na+,其质量为________g。
(2)4.5 mol CH4约含有________个CH4,其质量为________g。
(3)3.01×1023个SO42-约含有________mol SO42-,其质量为________g;49 g H3PO4约含有________个H,________个P,________个O,共含有________个原子。
查看答案和解析>>
科目: 来源: 题型:
【题目】(选做题)本题包括A、B两小题。请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
钴的合金及其配合物用途非常广泛。
(1)Co3+基态核外电子排布式为_____。
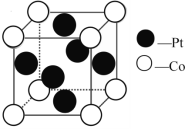
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为_____。
(3)BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为_____(用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_____(已知CO32—的结构式为:![]() )。
)。
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含![]() 键的数目为_____。
键的数目为_____。
B.[实验化学]
EDTA(乙二胺四乙酸)是螯合剂的代表物(沸点为116~117.2℃),可用于制备EDTAFeNa·3H2O等。实验室制备EDTA的实验步骤如下:
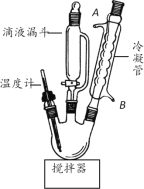
步骤1:在三口烧瓶中加入22.5gClCH2COOH、45mLH2O搅拌至溶解;在不断搅拌下,将含22gNaOH、60mLH2O、6.6g H2NCH2CH2NH2的盐酸盐所配成的溶液,从滴液漏斗中不断滴加到三口烧瓶中。
步骤2:加料完毕后,升温到102~106℃并保温,调节并保持 pH约为9,搅拌2h。
步骤3:加入活性炭,搅拌、静置、过滤。
步骤4:滤液用盐酸酸化至pH=1,放置、结晶、过滤、洗涤、干燥,制得EDTA。
(1)图中冷凝管装置的作用是_____,水从接口_____(填标号)通入。
(2)步骤3中加入活性炭的目的是_____;测定溶液pH的方法是_____。
(3)步骤4中“洗涤”时,能说明已洗涤完全的方法是_____。
(4)请补充完整由EDTA、NaHCO3、FeCl3·6H2O为原料制备EDTAFeNa·3H2O的实验方案(已知EDTANa4+FeCl3![]() EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答下列问题:
(1) O2和O3是氧元素的两种单质。根据分子式回答。
等质量的O2和O3的物质的量之比为________,所含分子数之比为________,原子个数比为____________。
(2) NO2和N2O4是氮元素的两种常见氧化物,常温下都是气体,它们之间在常温下就能相互转化,因而经常见到的是两种气体的混合物。现取46 g该气体,所含氮原子的物质的量为________,所含氧原子个数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-→ZnO+H2O,Ag2O+H2O+2e-→2Ag+2OH-。据此判断锌是( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com