
科目: 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH < 0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH < 0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A. 正反应速率:v(a)>v(c) v(b)>v(d)
B. 平衡时a点一定有n(CO):n(H2)=1:2
C. 平衡常数:K(a)>K(c) K(b)=K(d)
D. 平均摩尔质量:![]() (a)<
(a)<![]() (c)
(c)![]() (b)>
(b)>![]() (d)
(d)
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
查看答案和解析>>
科目: 来源: 题型:
【题目】以苯为原料合成一些化工产品的转化关系如下:

回答下列问题:
(1)A的名称是_________。
(2)C的结构简式为__________。
(3)B→D的反应类型是______;E中所含官能团名称是______。
(4)B→A的化学方程式为_________。
(5)写出E发生加聚反应方裎式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素a、b、c、d、e在周期表中的相对位置如图所示。已知a元素形成的物质种类最多。
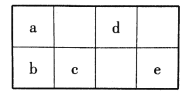
回答下列问题:
(1)在周期表中,b在元素周期表中的位置为______。
(2)b、c、e的气态氢化物热稳定性由强到弱的顺序为_____(用化学式表示)。
(3)在d的氢化物中,既含极性键又含非极性键的分子的电子式为____。
(4)a的单质在过量的d的单质气体中燃烧生成气态产物,转移1mol电子时放出的热量为98.75kJ。写出反应的热化学方程式:_______。
(5)请写出e单质与石灰乳制成漂白粉的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池B.铝合金大量用于高铁建设
C.水玻璃不燃不爆可用作耐火材料D.活性炭具有除异味和杀菌作用
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s) ![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B. CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0
C. 将容器体积增大为原来的2倍,平衡向正反应方向移动
D. 保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】用“>”“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
(2)相同条件下,2 mol氢原子所具有的能量______1 mol氢分子所具有的能量。
(3)已知常温下红磷比白磷稳定,比较下列反应中(反应条件均为点燃)ΔH的大小:ΔH1______ ΔH2。
①P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1,
②4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2。
(4)已知:101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则碳的燃烧热数值________110.5 kJ·mol-1。
(5)已知:稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量________57.3 kJ;稀硫酸和稀氢氧化钡溶液中和生成1 mol 水放出的热量_______________57.3 kJ。
(6)已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com