
科目: 来源: 题型:
【题目】下列关于物质分类的叙述正确的是
A.凡是含有共价键的化合物一定是共价化合物
B.凡是含有离子键的化合物一定是离子化合物
C.凡是非金属单质一定含有共价键
D.凡是含氧酸都是强电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下联氨(N2H4)的水溶液中有:
① N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
② N2H5++H2O![]() N2H62++OH- K2 ,
N2H62++OH- K2 ,
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是

A. 图中Ⅲ对应的微粒为N2H62+
B. 反应②为N2H5+的水解平衡方程式
C. 若C点为N2H5C1溶液,则存在:c(Cl-)>c(N2H5+ )+2c(N2H62+)
D. 据A点可求:K1=10-6
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液②NaHCO3溶液③NH4Cl溶液④NaOH溶液
(1)这4种溶液中由水电离的H+浓度最小的是__________。(填序号)
(2)②中各离子浓度由大到小的顺序是_____________,NaHCO3的水解平衡常数Kh=__________mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时![]() 的值__________(填“增大”、“减小”或“不变”)。
的值__________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”之一)。
查看答案和解析>>
科目: 来源: 题型:
【题目】国内某科技研究小组首次提出一种新型的Li+电池体系,该体系征集采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液采用LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知:I-+I2=I3-,则下列有关判断正确的是

A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 充电时,Li+从右向左通过聚合物离子交换膜
D. 放电时,负极的电极反应式为:

查看答案和解析>>
科目: 来源: 题型:
【题目】有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法正确的是
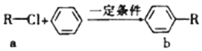
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种
D. 若R为C2H5时,1mol b最多可以与4molH2加成
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知:H2A的A2-可表示S2-、SO42-、SO32-、SiO32-或CO32-。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)=20 mL时,溶液中离子浓度大小关系:________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水________(填“大”、“小”或“相等”)。
(2)若H2A为硫酸:t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从2019年烧到2020年的澳大利亚山火终于熄灭了,在此次火灾中产生了大量的大气污染物:①浓烟中的炭粒 ②氮的氧化物 ③碳的氧化物 ④硫的氧化物,其中会导致雨水酸化的有害、有毒气体是
A.①③B.②④C.③④D.①②
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)pH相同的下列溶液中:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,c(NH4+)相对大小为(用序号回答)_______________。
(2)25℃时,将amol/L的氨水与0.01mol/L的盐酸溶液等体积混合,所得溶液呈中性。用含a的代数式表示一水合氨的电离平衡常数Kb=_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下表中烃的分子式排列规律,判断空格中的烃的同分异构体数目( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A. 2B. 3C. 4D. 5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com