
科目: 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法正确的是
)是最简单的一种。下列关于该化合物的说法正确的是
A. 与环戊烯不是同分异构体 B. 二氯代物超过两种
C. 生成1molC5H12,至少需要3molH2 D. 与丙炔互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】在某100mL混合酸中,HNO3物质的量浓度为0.4mol.L-1,H2SO4物质的量浓度为0.2mol.L-1。向其中加入足量的铜粉,待充分反应后,溶液中Cu2+物质的量浓度为
A.0.3mol.L-1B.0.225mol.L-1C.0.15mol.L-1D.无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
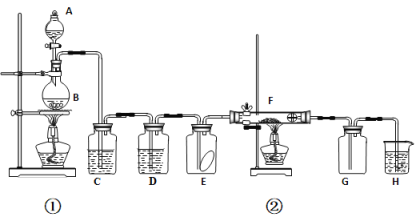
(1)A与B二者反应的化学方程式为____。
(2)在上述反应中,如有1 molCl2生成,被氧化的HCl的物质的量是___,转移电子的数目是___。
(3)C中试剂是___;D中试剂的作用是___。
(4)E中现象是_____。
(5)H中试剂为_____,作用是_____。
(6)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是___、__。(用①或②填写)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求书写方程式
(1)过氧化钠与CO2反应的化学方程式:___;
(2)将少量硫酸铝溶液滴入足量氨水中的离子方程式:___;
(3)铁与水蒸气反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚甲基丙烯酸羟乙酯(HEMA)是一种隐形眼镜的仿生材料,其单体的结构简式为:

回答下列问题:
(1)写出合成路线中C4H8的结构简式____________,写出它的系统命名法名称___________。
(2)D分子中含有的官能团名称为___________。
(3)反应②的试剂及条件为___________,反应⑤的反应类型为___________。
(4)写出反应⑥的化学方程式___________。
(5)写出由单体合成聚甲基丙烯酸羟乙酯(HEMA)的化学方程式___________。
(6)写出同时符合下列条件的C的同分异构体:___________。
①能与NaHCO3溶液反应放出气体 ②核磁共振氢谱中有3组吸收峰
查看答案和解析>>
科目: 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化业铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通人氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装詈(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
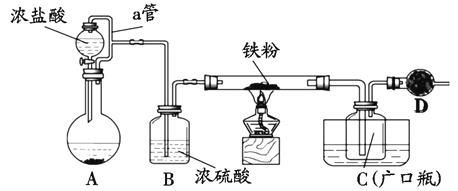
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为____。
(2)仪器D的名称是____;D中装的约品是碱石灰,其作用是____。
(3)定性分析。取C中的少量产物溶于稀盐酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的____(只能选取一种试剂,填序号)进行检测,实验现象是____。
①H2O2溶液 ②K3[Fe(CN)6]溶液 ③KSCN溶液
④酸性KMnO4溶液 ⑤KI一淀粉溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中铁元素的质量分数为____%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施:
①用题目所给的装置制得的产物中,铁元素含量____(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C![]() 2AlN+3CO合成.下列叙述不正确的是( )
2AlN+3CO合成.下列叙述不正确的是( )
A. AlN的摩尔质量为41g/molB. AlN中氮的化合价为-3
C. 每生成1mol AlN转移3mol电子D. 反应中N2是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】在烃的分子结构中,每减少2个氢原子,则碳碳间便增加一对共用电子。已知分子组成为CnH2n+2 的烃分子中碳碳间的共用电子对数为 n-1,则化学式为CnH2n-2 的烃分子结构中,碳碳间的共用电子对数为 ,Cx 也可视为烃脱氢后的产物,则C60 中碳碳间的共用电子对数为 ;若某碳单质分子中碳碳间的共用电子对数为 140 ,则该单质的分子式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为2L的真空密闭容器中加人1 mol CaCO3,发生反应:CaCO3(s) ![]() CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.
CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.
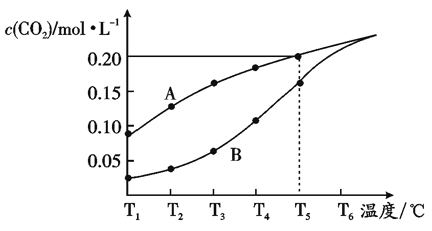
请回答下列问题:
(1)已知:①CaO(s)+SO2(g)==CaSO3(s) △H1=-402kJ·mol-1
②2CaCO3(s)+2SO2(g)+O2(g)==2CaSO4(s)+2CO2(g) △H2=-2762kJ·mol-1
③2CaSO3(s)+O2(g)==2CaSO4(s) △H3=-2315kJ·mol-1
则:CaCO3(s)==CaO(s)+CO2(g)的△H=____kJ·mol-1
(2)①温度为T5℃时,反应CaCO3(s) ![]() CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
②如果该反应的平衡常数K值变大,该反应____(选填编号)。
A.一定向逆反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向正反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则达到平衡时CaCO3的质量____(填“增大”、“减小”或“不变”)。
(4)在T5℃下,反应达到平衡状态后,再压缩容器为1L,重新达到平衡时,CO2的浓度____(填“增大”、“减小”或“不变”)
(5)随着温度的升高,曲线B向曲线A逼近的原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com