
科目: 来源: 题型:
【题目】将4gNaOH固体溶于水配制成250mL溶液,此溶液中NaOH的物质的量浓度为__________。取出10mL此溶液,其中含有NaOH_________g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 代表阿伏伽德罗常数的值,下列有关说法正确的是( )
代表阿伏伽德罗常数的值,下列有关说法正确的是( )
A.常温常压下,2.24 L SO2与O2混合气体中所含氧原子数小于0.2![]()
B.电解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1![]()
C.常温下,1 L pH=13的Ba(OH)2中含有的OH- 数目为0.2![]()
D.10 mL 98%的H2SO4溶液,加入水中稀释至100 mL,H2SO4的质量分数为9.8%
查看答案和解析>>
科目: 来源: 题型:
【题目】(双选)下列有关氯水的叙述,正确的是( )
A. 新制氯水只含有氯分子和次氯酸分子
B. 新制氯水可使紫色石蕊溶液先变红后褪色
C. 氯水光照时有气泡逸出,该气体的主要成分是氯气
D. 氯水放置数天后,其酸性逐渐增强
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化锂(Li3N)常作固体电解质和催化剂,遇水蒸气剧烈反应生成氢氧化锂和氨气。某实验小组用一瓶氮气样品制备纯净的氮化锂的装置如图所示。
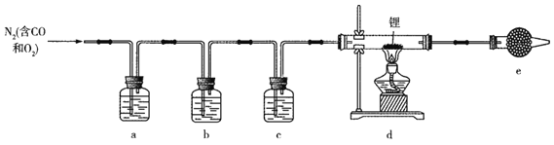
已知:连苯三酚碱性溶液能定量吸收少量O2,氯化亚铜盐酸溶液能定量吸收少量CO生成Cu(CO)Cl·H2O且易被O2氧化;在加热条件下,CO2与锂发生剧烈反应。下列说法正确的是
A. 干燥管e中试剂为无水CuSO4,用于检验氮气中的水蒸气
B. 为了减少气体用量,先点燃酒精灯再通入氮气
C. a、c中试剂分别为连苯三酚碱性溶液、浓硫酸
D. a装置可以换成盛装赤热铜粉的硬质玻璃管
查看答案和解析>>
科目: 来源: 题型:
【题目】某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:
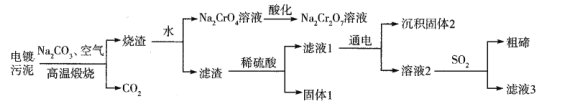
已知:碲和硫位于同主族,煅烧时Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4=TeOSO4+H2O。下列说法不正确的是
2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4=TeOSO4+H2O。下列说法不正确的是
A. “高温”灼烧电镀污泥时铜碲和铬元素都被氧化
B. 酸化Na2CrO4溶液时可用浓盐酸
C. 上述流程可以回收的金属单质有金和铜
D. 滤液3可以循环利用
查看答案和解析>>
科目: 来源: 题型:
【题目】以重晶石(主要成分是BaSO4,含Al、Fe等元素的杂质)为原料制备产品(BaCl2·2H2O)的一种流程如下:
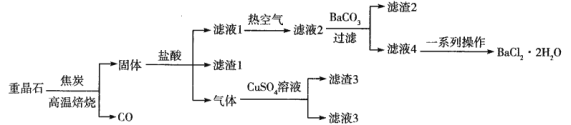
已知:滤液2主要含BaCl2,还含有AlCl3、FeCl3和HCl等杂质。298K下,Fe(OH)3、Al(OH)3完全沉淀的pH依次为3.0和5.4。
回答下列问题:
(1)高温焙烧时将重晶石粉碎的目的是______________________。若4.66 g BaSO4完全反应转移9.632×1022个电子,写出BaSO4与C反应的化学方程式:______________________。
(2)“固体”(微溶于水)与盐酸反应生成的一种气体通入CuSO4溶液中产生黑色沉淀,则生成该气体的离子方程式为______________________。滤渣3的成分是___________(填化学式)。
(3)加入BaCO3的目的是____________________________________________。
(4)常温下,Fe3+沉淀完全[溶液中c(Fe3+)=1×10-5mol·L-1]时溶液的pH=3,则Fe(OH)3的Ksp约为_____。
(5)滤液4经蒸发浓缩、降温结晶、过滤,洗涤和干燥,得到产品。采用电化学法以过滤后的废液为原料制备Ba(OH)2,实现资源综合利用和环境保护。气体X的电子式为____________________;写出阴极的电极反应式:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通过电解精制饱和食盐水来制备NaOH、H2、Cl2,再合成盐酸。完成下列填空:
(1)粗盐提纯:为除去粗盐中的Ca2+、Mg2+、SO42—。向粗盐溶液中依次加入稍过量的NaOH溶液、______,过滤后,再向滤液中加入适量__________,再蒸发。
(2)电解饱和食盐水:25℃,电解10L饱和食盐水,若阴极收集到标准状况下11.2L_______(填气体化学式),则溶液pH=_______(设溶液体积、温度不变、忽略生成物间的反应)。
(3)工业制盐酸:利用Cl2和H2化合,所得产物再溶于水的方法制得盐酸,生产流程如下:
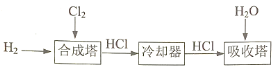
为确保Cl2完全反应,合成塔中n(H2)略大于n(Cl2)。写出一条Cl2必须反应完全的理由:______。
(4)盐酸浓度测定:可用滴定法,用盐酸滴定已知质量Na2CO3的溶液。过程如下:准确称量一定质量的Na2CO3固体于锥形瓶中,加蒸馏水使其溶解,滴加指示剂X,用待测盐酸滴定,接近终点时,加热锥形瓶,煮沸液体2min,冷却至室温,继续滴定至终点,记录消耗盐酸的体积。重复上述过程三次,计算盐酸浓度。
已知:指示剂X的变色范围是5.0~5.2; 25℃,饱和CO2水溶液pH≈4。
①本测定用的仪器有锥形瓶、烧杯、玻璃棒、____________________________________。
②本测定的反应原理是________________________________(用化学方程式表示)。
③接近终点时煮沸反应混合物的目的是_______________________________。
④盛放Na2CO3固体的锥形瓶不干燥,对实验结果的影响是_________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】误差
(1)在转移溶液时有部分溶液溅出,则配制的溶液浓度___________(填“偏高”、“偏低”或“不变”,下同);
(2)转移溶液后,没有用水洗涤烧杯内壁,溶液浓度将__________;
(3)加水超过容量瓶的刻度线,溶液浓度将__________,此时应该_______________;
(4)加水定容时俯视刻度线,溶液浓度将__________;
(5)定容后将溶液摇匀,发现液面下降,又加水到刻度线,溶液浓度将_________。
(6)烧碱溶解后,没有恢复到室温,就转移到容量瓶中进行配制,浓度将____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com