
科目: 来源: 题型:
【题目】药物H的一种合成路线如下:

已知:R-C![]() CH+H2O
CH+H2O![]()
![]()
请回答下列问题
(1)A的名称是___________;B→C的反应条件和试剂:______________________。
(2)E中含氧官能团名称是___________;G→H的反应类型是___________。
(3)写出E→F反应的化学方程式_________________________________。
(4)1个有机物C分子最多有___________个原子共平面。
(5)化合物F有多种同分异构体,同时满足下列条件的同分异构体有___________种;其中核磁共振氢谱有5组峰且峰面积之比为1︰2︰2︰2︰3的物质的结构简式为___________。
①能发生水解反应;②属于芳香化合物且能发生银镜反应
(6)参照上述信息,以丙醛(CH2CH2CHO)为主要原料合成![]() (其他试剂任选),设计合成路线:______。
(其他试剂任选),设计合成路线:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料。
回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)AsCl3分子中砷的杂化类型是___________;AsO43-的空间构型是___________。
(3)电子亲和能是反映元素性质的参数之一,电子亲和能指基态气态原子得1个电子形成负一价阴离子时释放的能量(kJ·mol-1),第四周期主族元素Ga、Ge、As、Se、Br的电子亲和能大小变化如图所示。砷的电子亲和能“突变”的主要原因是_________________________________。

(4)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。配位原子提供孤电子对的能力与元素的电负性大小有关,电负性越大,其原子不容易提供孤电子对,则Fe(CO)5中提供孤电子对的原子是__ (填元素符号);与CO互为等电子体的分子是___________。
(5)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是___________。
(6)氧化镍晶胞如图1所示,单原子层氧化镍的结构如图2所示。

①图1中,原子坐标参数:A(0,0,0)、B(![]() ,0,
,0,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
②图2中,已知氧离子半径为apm(忽略镍离子半径),NA是阿伏加德罗常数的值。每平方米含氧化镍的质量为___________g。(提示:将图2中氧离子切割成正六边形作最小基元)
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”ke牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2H2(g)+O2(g) ===2H2O(l) ΔH=-571.66 kJ·mol-1
CO(g)+1/2O2(g) ===CO2(g) ΔH=-282.9 kJ·mol-1
若氢气与一氧化碳的混合气体完全燃烧可生成2.7 g H2O(l),并放出57.02 kJ热量,则混合气体中CO的物质的量约为( )
A. 0.22 mol B. 0.15 mol C. 0.1 mol D. 0.05 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2 ![]() 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(1),△H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D. 已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 则△H1<△H2
查看答案和解析>>
科目: 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )

A. 电池工作时,正极反应式为O2+2H2O+4e-===4OH-
B. 电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极
C. 试管中NaOH溶液用来吸收电解时产生的Cl2
D. 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.021 mol气体
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) ![]() CH3OH(g)
CH3OH(g)
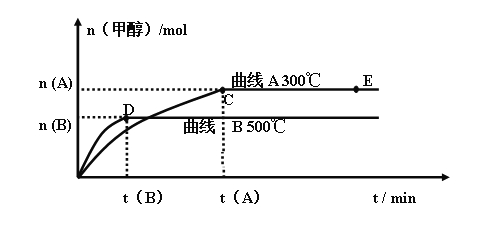
不同温度时甲醇的物质的量随时间变化曲线如上图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,化学平衡常数K值____________(填“增大”、“减小”或“不变”)。
(2)在其他条件不变的情况下,将E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是___________
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
Ⅱ、在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
T(℃) | 700 | 800 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.7 | 2.6 |
(1) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.053 mol,若将混合气体加热至830℃,平衡时CO2的物质的量_____ (填“大于”、等于“”或“小于”)0.053 mol。
(2)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸银是中学实验室常用试剂。硝酸银不稳定,易发生如下反应:
①2AgNO3(s)= 2Ag(s)+ 2N02(g)+O2(g) △H1
②2NO2(g)![]() N2O4(g) △H2
N2O4(g) △H2
(1)2AgNO3(s)= 2Ag(s)+N2O4(g)+O2(g) △H=___________(用含△H1、△H2的式子表示)。
(2)实验室配制硝酸银溶液的操作方法是:将一定量硝酸银固体溶于浓硝酸中,加水稀释至指定体积。“硝酸”的作用是____________________________________________。
(3)一定温度下,在5L的恒容密闭容器中投入34 g AgNO3(s)并完全分解测得混合气体的总物质的量(n)与时间(t)的关系如图所示。
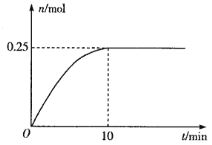
①下列情况能说明体系达到平衡状态的是___________(填字母)
a.Ag粉的质量不再改变 b.O2的浓度不再改变
c.NO2的体积分数不再改变 d.混合气体的密度不再改变
②反应开始到10min内N2O4的平均反应速率为___________mol·L-1·min-1。
③若达到平衡时,混合气体的总压强p=3.0MPa。在该温度下2NO2(g)![]() N2O4(g)的平衡常数Kp=___ (MPa)-1(结果保留2位小数)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1)=平衡时总压(P)×该组分的体积分数(
N2O4(g)的平衡常数Kp=___ (MPa)-1(结果保留2位小数)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1)=平衡时总压(P)×该组分的体积分数(![]() )]
)]
④达到平衡后,再向容器中充入少量的NO2,平衡2NO2(g)![]() N2O4(g)___________(填“向左”“向右”或“不”)移动,NO2的平衡转化率___________(填“增大”“减小”或“不变”)。
N2O4(g)___________(填“向左”“向右”或“不”)移动,NO2的平衡转化率___________(填“增大”“减小”或“不变”)。
(4)已知几种难溶物的溶度积如下表所示:
难溶物 | AgI | AgSCN | AgCl | Ag2CrO4 | Ag2S |
溶度积 | 8.5×10-17 | 1.2x10-12 | 1.8×10-10 | 1.1×10-11 | 6.7×10-50 |
颜色 | 黄色 | 白色 | 白色 | 红色 | 黑色 |
实验室常用AgNO3溶液滴定Cl-,宜选择___________作指示剂(填字母)
A.KI B. NH4SCN C. Na2CrO 4 D.K2S
(5)工业上,常用电解法精炼粗银。粗银中含有Cu、Au等杂质,用AgNO3溶液作电解质溶液。若以电流强度aA,通电bmin后,制得精银的质量为ckg,则该精炼装置的电流效率为___________(只要求列出计算式即可)。[已知:1mol电子带96500C(库仑)电量,电流效率等于阴极得电子数与通过电子总数之比]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com