
科目: 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题。
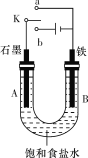
(1)若开始时开关K与a连接,则A极的电极反应式为_____________________。
(2)若开始时开关K与b连接,则B极的电极反应式为____________________。
(3)若用铝条和镁条分别代替图中石墨和铁电极,电解质溶液为氢氧化钠溶液,请写出原电池负极的电极反应式_____________________________。
(4)若用二氧化铅和铅作电极,硫酸溶液为电解质溶液构成铅蓄电池,则充电时阳极的电极反应式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________。
(2)制备焦亚硫酸钠Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
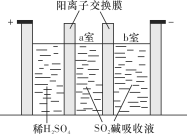
(3)利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为____________________。(离子交换膜只允许OH-通过)
 .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘元素,其主要形式为I-,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(已知:①苯是一种不溶于水,密度比水小,易挥发的液体;②MnO2和稀硫酸可以将I-转化为I2)。下列说法正确的是( )

A. 步骤①灼烧海带需要用到的实验仪器有三脚架、蒸发皿、泥三角、酒精灯
B. 步骤③实验操作静置后的操作为,先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
C. 如果想尽可能多地把碘从水溶液中转移到苯中,应采取的操作为:加入适量萃取剂多次萃取
D. 步骤⑥为蒸发,目的是从含碘的苯溶液中分离出单质碘
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。
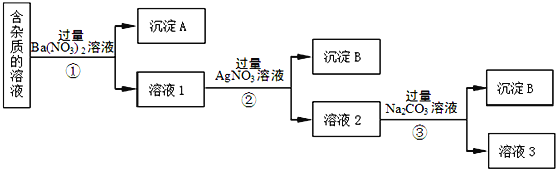
(1)沉淀A的主要成分是___、___(填化学式)。
(2)③中加入过量的Na2CO3溶液的目的是___。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是___,为了除去杂质,可向溶液3中加入适量的____。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。常温下,若所得溶液pH=13,CO2主要转化为________(写离子符号);若所得溶液c(HCO3-)∶c(CO32-)=2∶1,溶液pH=__________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH-)=________________mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c(CrO42-)等于__________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钼(Mo)及其合金在冶金、农业、电气、化工、环保和宇航等重要领域有着广泛的应用和良好的前景,成为国民经济中一种重要的原料和不可替代的战略物质。钼酸钠晶体(Na2MoO4 ·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分 MoS2 )制备钼酸钠晶体和金属钼的流程如图所示:

请回答下列问题:
(1)Na2 MoO 4·2H2O 中 Mo 的化合价是 ________。
(2)已知“焙烧”过程中 MoS2 变成 MoO3,则气体 1 中对大气有污染的是 ________。
(3)“碱浸”过程中生成 Na2MoO4 的化学方程式是 ________;“结晶”的钼酸钠晶体仍含其他杂质,要得到较纯的晶体,还应采取的方法是 ________。
(4)“滤液”的主要成分是 ________。
(5)将过滤操作得到的钼酸沉淀进行高温焙烧,实验室模拟高温焙烧时用于盛放钼酸的仪器是 ________。
(6)钼酸高温焙烧的产物与 Al 在高温下发生反应的化学方程式是 ________。
(7)测得碱浸液中部分离子浓度为:c(MoO42-) =0.4 mol·L-1,c(SO42-) =0.02 mol·L-1。结晶前加入氢氧化钡固体除去SO42-,不考虑加入氢氧化钡固体后溶液体积的变化,当BaMoO4开始沉淀时,SO42- 的去除率为 ________ (保留三位有效数字)。 [已知: Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在标准状况下,0.5mol N2和1mol O2 的混合气体的体积约是_____.
(2)标准状况下,气体的摩尔体积是______,0.5mol CO2 的质量是____,在标准状况下的体积是_____.
(3)①标准状况下,2mol NH3与 _______g CO2的体积相等.
②等质量的O2和O3所含的原子个数之比是______.
③用金属Na、Mg、Al与足量的稀盐酸反应,欲制取相同条件下等体积的H2,则需要金属Na、Mg、Al的质量比为_____(最简整数比).
④已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的相对分子质量为__.
查看答案和解析>>
科目: 来源: 题型:
【题目】粗盐中含Ca2+、Mg2+、Fe3+、SO42—等杂质,需要提纯后才能综合利用。为除去粗盐中的杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)提纯的步骤有:①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解⑥过滤⑦蒸发,正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)操作Z的名称是_____,蒸发操作用到的仪器有酒精灯,玻璃棒,三脚架,泥三角还有 ________。
(3)第Ⅱ步中,写出除去Ca2+和Fe3+相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2,Fe3+的主要存在形式为FeCl3)____________________、____________________。
(4)判断SO42—已沉淀完全的方法是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-![]() FeO42-+3H2↑,工作原理如图所示。下列说法不正确的是
FeO42-+3H2↑,工作原理如图所示。下列说法不正确的是
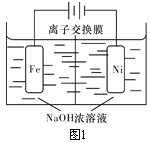
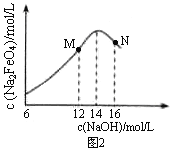
(已知:Na2FeO4只在强碱性条件下稳定,易被H2还原)
A. 装置通电后,铁电极附近生成紫红色的FeO42-
B. M点表示氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质
C. 氢氧根离子从镍极区通过交换膜到达铁极区域
D. 电解过程中,须将阴极产生的气体及时排出
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com