
科目: 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g) H<0,若在恒容绝热容器中发生,下列选项表明反应一定已达平衡状态的是
2HI(g) H<0,若在恒容绝热容器中发生,下列选项表明反应一定已达平衡状态的是
A. 混合气体的密度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开1mol H-H键的同时生成2mol H-I键
D. 容器内气体的浓度c(H2)∶c(I2)∶c(HI) = 1∶1∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】将生物质气(主要成分为CO、CO2和H2)甲烷化是改善燃气质量、改善燃气热值的有效手段之一。在催化剂的作用下,某密闭容器中,进行生物质气甲烷化时发生的主要反应为
①CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1;
CH4(g)+H2O(g) △H1;
②CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H2=-165.1kJ·mol-1;
CH4(g)+2H2O(g) △H2=-165.1kJ·mol-1;
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1。
CO2(g)+H2(g) △H3=-41.2kJ·mol-1。
请回答下列问题:
(1)△H1=___________,该反应在___________(填“高温”或“低温”)条件下能够自发进行。
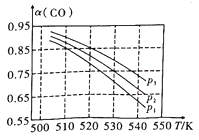
(2)在合成气投料比保持恒定时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示。α(CO)随温度升高而减小的原因是______________________。图中的压强由大到小的顺序为___________。
(3)温度为T1℃,在三个容积均为1L的恒容密闭容器中仅发生反应CO(g)+3H2(g)![]() CH4(g)+H2O(g),该反应中,正反应速率为v正=k正c(CO)c3(H2),逆反应速率为v逆=k逆c(CH4)·c(H2O),k正、k逆为速率常数,受温度影响。在第I个容器中,3min反应达到平衡时,CH4与CO的体积分数相同,则氢气的速率v(H2)=___________;下列说法正确的是___________(填序号)。
CH4(g)+H2O(g),该反应中,正反应速率为v正=k正c(CO)c3(H2),逆反应速率为v逆=k逆c(CH4)·c(H2O),k正、k逆为速率常数,受温度影响。在第I个容器中,3min反应达到平衡时,CH4与CO的体积分数相同,则氢气的速率v(H2)=___________;下列说法正确的是___________(填序号)。
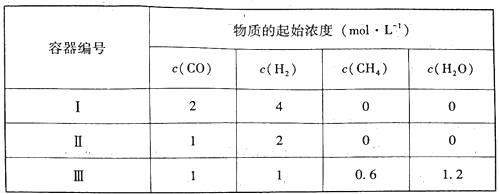
A.当温度改变为T2时,若k正=1.5k逆,则T2>T1
B.达平衡时,容器Ⅱ中H2的体积分数小于25%
C.达平衡时,容器Ⅲ与容器I中的总压强之比小于19︰20
D.达平衡时,容器Ⅱ中α(CO)大于容器I中α(CO)
(4)甲烷可作燃料电池的原料,若电解质为盐酸,当外电路转移16mol电子时(不考虑电子的损失),将负极产生的气体全部通入到2L1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、二氧化碳、氧气作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”(碱式碳酸铜),“铜绿”能跟酸反应生成铜盐、二氧化碳和水。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于物质的类别是____。
(2)请写出铜绿与盐酸反应的化学方程式_____。
(3)写出B的化学式_____。
(4)上述转化过程中属于化合反应的是___,属于复分解反应的是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】向绝热恒容的密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g) ![]() SO3(g)+NO(g),其正反应速率(v正)随时间(t)变化的关系如图所示。下列结论中错误的是( )
SO3(g)+NO(g),其正反应速率(v正)随时间(t)变化的关系如图所示。下列结论中错误的是( )

A. 反应在c点达到平衡状态
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D. 逆反应速率:c点大于b点
查看答案和解析>>
科目: 来源: 题型:
【题目】辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是____,当1 mol O2发生反应时,还原剂所失电子的物质的量为_____mol, 其中被S 元素还原的O2的物质的的量为__________mol 。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,向0.1moLH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。已知常温下,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。下列说法错误的是
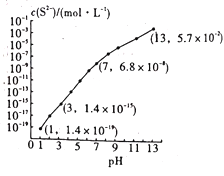
A. 当溶液中c(S2-)=1.4×10-19mol/L时,溶液中由水电离出的H+浓度为1.0×10-13mo/L
B. 0.1mo/LNa2S溶液中离子浓度之间的关系为:c(Na+)>c(HS-)+2c(S2-)
C. 常温下,0.1 mol/L NaHS溶液的pH<7
D. 当pH=13时,溶液中的c(H2S)+c(HS-)=0.043mo/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com