
科目: 来源: 题型:
【题目】已知MOH为一元弱碱,25℃时,电离常数Kb=1×10- 6 mol·L-1。25℃时,0.01 mol·L-1 MOH溶液的pH=10,将其与等体积pH=4的盐酸溶液混合,则混合溶液的pH_____7(填“>”、“<”或“=”),试求此时溶液中MCl的水解平衡常数Kh=__________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条退色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中属于离子化合物是( )
①MgF2 ②Na2O2 ③KOH ④CO2 ⑤NaClO ⑥H2SO4
A. ②③⑤B. ②③④⑤C. ①②③⑤D. ①③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】对炼锌厂的铜镉废渣中各元素进行分离,能减少环境污染,同时制得食品锌强化剂的原料ZnSO4·7H2O实现资源的再利用。其流程图如下。

[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO![]() 。
。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高铜镉废渣浸出率可以采用的方法是(写出其中一点即可)____;
(2)向滤液I中逐滴滴人酸性KMnO4溶液可与AsO![]() 发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____;
(4)上述流程除了实现对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用,还可以得到副产物___
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池的工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的正极反应式为____;
(6)若a克铜镉废渣含有b molFe元素,加入了c mol KMnO4,则铜镉废渣中As元素的质量分数为____。(不考虑镉元素与KMnO4的反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R'![]()
![]()
ⅲ.R—HC=CH—R'![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)D中官能团名称为_____,A的化学名称为_____。
(2)F的结构简式为_____,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为_____,反应类型为_____。
(4)下列说法不正确的是_____(选填字母序号)。
a.可用硝酸银溶液鉴别B、C两种物质
b.由H生成M的反应是加成反应
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成![]() 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—选修3:物质结构与性质】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为 。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为 。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属 分子(选填“极性”“非极性”),其立体构型为 。
(3)橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂。该晶体属于 晶体,三种元素电负性由大到小的顺序为(填元素符号) 。配体CO中σ键与π键数之比是 。

(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如上图所示,分子内的作用力不可能含有 (填序号)。
A离子键 B共价键 C金属键 D配位键 E氢键
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图所示,已知钨的密度为ρ g·cm-3,则每个钨原子的半径r= cm。(只需列出计算式)

查看答案和解析>>
科目: 来源: 题型:
【题目】NO2是形成雾霾天气的原因之一。
(1)重型车辆常在排气管内喷淋尿素[CO(NH2)2]溶液,使NO2转化为无污染物质。采用“喷淋”的目的是 ,反应的活化能 (选填“增大”“减小”“不变”),写出该反应的化学方程式: 。【已知:CO(NH2)2中N呈-3价】
(2)以CO2与NH3为原料可合成化肥尿素。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s) =CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式 。
(3)恒温下将1.6 mol NH3和0.8 mol CO2放入容积为8 L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是 。
a.容器内气体压强保持不变 b.CO2与NH3的速率之比为1∶2
c.NH2CO2NH4(s)质量保持不变 d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05 mol·L-1。则平衡时CO2的转化率α= ;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率 (选填“增大”“减小”“不变”)。

(4)为减少NO2排放,可将NO2转化为NO后通入如右图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。
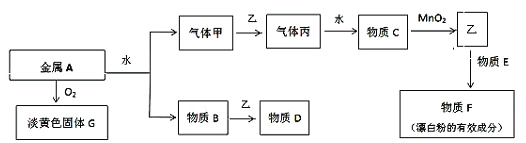
请根据以上信息回答下列问题:
(1)写出下列物质的名称:丙- ;
(2)写出下列物质的化学式:F________________;
(3)气体乙是一种重要的化工原料,在工农业牛产、牛活中有着重要的应用。请你根据所学
知识回答下列问题:
把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因 。
某化学兴趣小组计划用气体乙和物质B制取简易消毒液D。其反应原理为:(用化学方程式
表示)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
③BaSO3难溶于水,可溶于稀HCl。
实验装置如图所示(省略夹持装置)
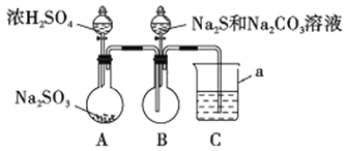
(1)仪器a的名称是_________;C中的试剂可以是______ (选填下列字母编号)。
A.稀H2SO4 B.酸性KMnO4溶液 C.饱和NaHSO3溶液 D.NaOH溶液
(2)此实验装置设计有缺陷,其改进方法是_________________________。
(3)写出B中反应的离子方程式_________________________________________。
(4)A、B中反应完后,在拆装置前,应将其中污染空气的有毒气体除去,采用的方法和具体操作是________________________________________。
(5)该法所得产品中常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,加足量BaCl2溶液,有白色沉淀生成,_______________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(6)测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2=S4O62-+2I-)
①滴定至终点时,溶液颜色的变化是_______________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 19.45 |
第四次 | 0.00 | 16.00 |
③产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com