
科目: 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了下图的实验装置。B中盛有饱和碳酸氢钠溶液,E为收集氧气装置。
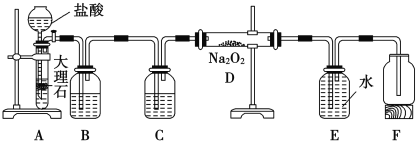
(1)写出装置A中发生反应的化学方程式_________。
(2)装置B的作用是_______,发生反应的方程式为_______。
(3)装置C的作用是___________。
(4)写出装置D中发生反应的化学方程式__________。
(5)指出装置E的错误__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:用NH3催化还原NOx时包含以下反应。
反应①:4NH3(g) + 6NO(g) ![]() 5N2(g) + 6H2O(l) H1 = -1807.0kJmol-1
5N2(g) + 6H2O(l) H1 = -1807.0kJmol-1
反应②:4NH3(g) + 6NO2(g) ![]() 5N2(g) + 3O2(g) + 6H2O(l) H2 = ?
5N2(g) + 3O2(g) + 6H2O(l) H2 = ?
反应③:2NO(g) + O2(g) ![]() 2NO2(g) H3 = -113.0kJmol-1
2NO2(g) H3 = -113.0kJmol-1
(1)反应②的H2 =_________________________。 反应①②在热力学上趋势大,其原因是___________________________________________________________________。
(2)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。

①反应①的平衡常数的表达式K=__________。在催化剂甲的作用下反应的平衡常数_______________在催化剂乙的作用下反应的平衡常数(填写“大于”,“小于”或“等于”)。
②N点后N2浓度减小的原因可能是_________________、 ________________。
(3)某温度下,在1L容器中对于反应①初始投入4molNH3和6molNO,当气体总物质的量为7.5mol时反应达到平衡,则NH3的转化率_______________% ,达平衡所用时间为5分钟,则用NO表示此反应平均反应速率为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学可以变废为宝,利用电解法处理烟道气中的NO,将其转化为NH4NO3的原理如下图所示,下列说法错误的是

A. 该电解池的阳极反应为:NO - 3e- + 2H2O = NO3- + 4H+
B. 为使电解产物全部转化为NH4NO3,需补充物质A为HNO3
C. 该电解池的电极材料为多孔石墨,目的是提高NO的利用率和加快反应速率
D. 用NH4NO3的稀溶液代替水可以增强导电能力,有利于电解的顺利进行
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.用固体烧碱配制480mL 0.1 mol·L-1的NaOH溶液,请回答以下问题:
(1)需称量_______g烧碱固体,它应盛在_____中进行称量。
(2)配制过程中,不需要使用的仪器是(填序号)_____________。
A、托盘天平 B、药匙 C、烧杯 D、胶头滴管 E、玻璃棒 F、1000mL容量瓶 G、500mL容量瓶
(3)若配制0.1 mol·L-1的NaOH溶液的其他操作均正确,但出现下列错误操作,其中将使配制的NaOH溶液浓度偏高的是___________(填序号)。
A.将NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的NaOH溶液向容量瓶中转移时,因操作不当使部分溅出瓶外
C.定容摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
D.定容时俯视容量瓶的刻度线
Ⅱ.欲用98% 的浓硫酸(ρ=1.84 g·cm-3 )配制成浓度为0.5 mol·L-1 的稀硫酸480mL。
(1)所需浓硫酸的体积为___mL。
(2)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和___。
(3)操作正确的顺序为_____(填序号)。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度
D.将配制好的溶液转入试剂瓶中贴上标签 E.稀释浓硫酸 F.将溶液转入容量瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】利用相关知识填空.
(1)标准状况下11.2LNH3中含______个氨分子,含______mol氢原子.
(2)等质量的SO2和SO3物质的量之比是_______;所含的氧原子个数之比是______.
(3)4.8gCH4中所含氢原子数与______g水所含氢原子数相等.
(4)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为______.
(5)标况下,一定量的N2与22.4LCO所含电子的物质的量相等,则N2的质量是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3mL酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
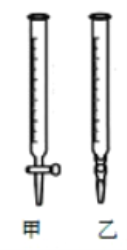
(1)以上步骤有错误的是(填编号)________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.量取待测液的滴定管用蒸馏水洗涤后,未用待测液润洗
D.装标准溶液的滴定管滴定前仰视读数,滴定后俯视读
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于吸热反应的是( )
A. 生石灰与水的反应B. 甲烷在氧气中燃烧
C. Fe与稀盐酸的反应D. Ba(OH)2·8H2O和NH4 Cl(固体)反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下 :(废料中的其他金属含量较低,对实验影响可忽略)

已知:① AgCl可溶于氨水,生成[Ag(NH3)2]+;
② Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取____________措施(写出其中一种即可)。
(2)操作IV经过_______________、_________________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是________________________________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:1)。氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com