
科目: 来源: 题型:
【题目】草酸(H2C2O4)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1)H2C2O4 (s) ![]() H2O(g)+CO(g)+CO2(g) △H=+340kJ·mol-1,写出此反应的平衡常数表达式 K= ;密闭容器中,保持温度不变,下列有关选项正确的是( )
H2O(g)+CO(g)+CO2(g) △H=+340kJ·mol-1,写出此反应的平衡常数表达式 K= ;密闭容器中,保持温度不变,下列有关选项正确的是( )
A.恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态
B.恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态
C.气体摩尔体积不再发生变化,说明该反应已达到化学平衡状态
D.气体平均摩尔质量不再发生变化,说明该反应已达到化学平衡状态
(2)草酸分解所需燃料可以是CO,通过甲烷制备CO:
CH4(g)+CO2(g) 2CO(g)+2H2(g) △H >O。常温下,在2 L的密闭容器中通入4 mol CH4气体和6 mol CO2气体发生反应,5min后达到平衡,测得CO气体的浓度为0.1 mol·L-1。
①平衡时,该反应的平均反应速率v(CO2)= mol·L-1min-1。
②在不改变反应混合物用量的前提下,为了提高CH4气体的转化率,可采取的措施是 。
(3)电解饱和草酸溶液可以制得高档香料乙醛酸(H2C2O3),装置如下图1所示,写出复合膜电极的电极反应式 。

(4)在K3Fe(C2O4)3溶液中存在:[Fe(C2O4)3]3-Fe3++3C2O42-,常温下,该溶液中
[Fe(C2O4)3]3-的浓度与温度的关系如上图2所示,则A点的c(Fe3+) B点的c(Fe3+) (填“<”“>”或“=”);草酸是一种温和的还原剂,其他条件不变,向K3Fe(C2O4)3溶液中加入少量KMnO4固体,Fe3+的浓度 (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年是太原市创建第六届全国文明城市的攻坚之年,目标是努力打造宜居、宜业、宜乐、宜游的良好环境,持续提升城市文明程度和市民文明素质。下列做法不符合这一目标的是( )
A.使用可降解快餐盒
B.种植绿色无公害蔬菜
C.随意丢弃使用过的医用口罩
D.将普通灯泡更换为LED节能灯
查看答案和解析>>
科目: 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.
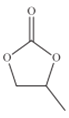
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。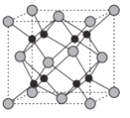
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学做了如下实验:
装置 |
|
|
现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
下列说法中不正确的是
A. 往铁片Ⅰ所在烧杯加入蒸馏水,电流表指针会发生偏转
B. 用K3[Fe(CN)3]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极
C. 铁片Ⅰ、Ⅲ的腐蚀速率不相等
D. “电流计指针未发生偏转”,铁片Ⅰ、铁片Ⅱ均未被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是
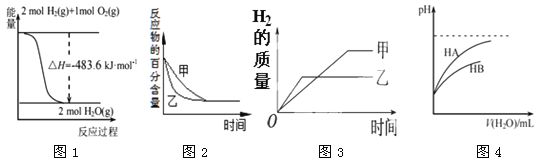
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是
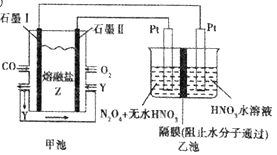
A. 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
B. 石墨I是原电池的负极,发生氧化反应
C. 乙池中左端Pt极电极反应式:N2O4-2e-+2H2O===2N2O5+4H+
D. 甲池中的CO32-向石墨I极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6mol电子,则有1molCr2O72-被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用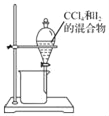 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用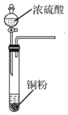 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用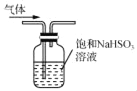 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用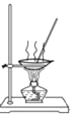 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】用电化学制备正十二烷的方法:向烧杯中加入50 mL 甲醇,不断搅拌加入少量金属钠,再加入11 mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应: 2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,下列说法不正确的是
C12H26+2CO2↑+H2↑+2CH3ONa,下列说法不正确的是
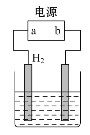
A. 图中电源的a极为直流电源的负极
B. 电解过程中离子浓度会不断降低
C. 阳极电极反应:2C6H13COO--2e-=C12H26+2CO2↑
D. 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是

A. A有5种正价,与B可形成6种化合物
B. 工业上常通过电解熔融态C2B3的方法来获得C的单质
C. D和E两元素形成的化合物每种原子最外层都达到了8e稳定结构
D. 简单离子的半径由大到小为:E>A>B>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com