
科目: 来源: 题型:
【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 探究浓度对平衡的影响 | 各取2mL0.1mol/L的重铬酸钾溶液于两支试管中,分别加入5~15滴浓硫酸和5~15滴6mol/L氢氧化钠溶液, 记录溶液颜色的变化 |
B | 探究温度对平衡的影响 | 将两份等浓度含有少量酚酞的氨水分别置于冰水浴和40℃热水浴中(忽略NH3的挥发),记录溶液颜色的 变化 |
C | 制取并纯化氯气 | 向高锰酸钾固体中滴加浓盐酸,将产生的气体依次通过饱和食盐水、浓硫酸的洗气瓶 |
D | 证明催化效果Fe3+>Cu2+ | 向2支盛有2 mL相同温度,相同浓度H2O2溶液的试管中同时加入5滴氯化铁溶液和硫酸铜溶液,观察实验现象 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO42-。提纯的操作步骤和加入试剂的情况如图1:
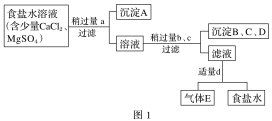
图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)生成沉淀A的化学方程式:_________。
(2)试剂d是_______;判断试剂d已经足量的简单方法为_______;如果在加入d试剂前没有过滤,引起的后果是________。
(3)沉淀B、C、D的化学式分别为(不讲顺序)________。
(4)现有如图2仪器,过滤出沉淀A、B、C、D时必须用到________(填序号)。
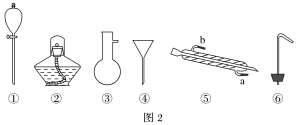
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的_______(填序号);实验时③中除加入适量海水外,还需加入_______,其作用是________。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述中的仪器,该仪器名称________。为了使该仪器中液体可以顺利流下,应进行的具体操作是________。分液后提取碘单质的实验操作名称为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,左图为其工作原理,右图为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是
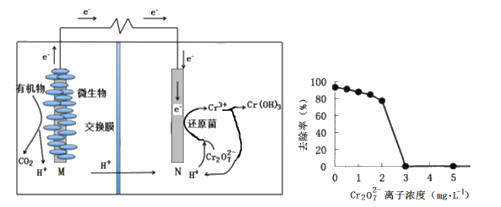
A. 有机物被氧化,M为电源负极
B. 电池工作时,N极附近溶液pH增大
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. 处理0.1 mol Cr2O72-时有1.4 mol H+从交换膜左侧向右侧迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) ![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 在标准状况下,11.2L某气体的质量为22g,则该气体的相对分子质量是44g/mol
B. 16gO2和16gO3含的氧原子个数一样多
C. 在标准状况下,水、氧气和氮气分子间的平均距离相等
D. 在标准状况下,1molSO3的体积约为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氧化性强弱:Cl2>Br2>Fe3+;还原性强弱:Fe2+>Br->Cl-
(1)下列反应能够发生的是:___(可多选);
A.Cl2+2Fe2+=2Cl-+2Fe3+ B.2Cl-+Br2=Cl2+2Br-
C.Br2+2Fe2+=2Br-+2Fe3+ D.2Fe3++2Br-=2Fe2++Br2
(2)把少量的氯气通入FeBr2溶液中时,氯气可以氧化Fe2+和Br-,请问氯气先氧化哪一种离子?___(填写离子符号);
(3)往250mLFeBr2溶液中通入8.96LCl2(标准状况),反应完成后,溶液中1/2的Br-被氧化为溴单质,则原FeBr2溶液的物质的量浓度为多少?___
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子有三个电子层,最外层上有一个电子:B元素-2价阴离子的电子层结构与氩原子相同;C元素的原子核内无中子:D原子核外电子数比A原子核外电子总数多6个。
(1)写出A、B、C、D四种元素的符号:A________、B________、C________、D________。
(2)写出与A的电子层结构相同的两种离子的离子符号________、________。
(3)写出B离子的电子式________________,D原子的结构示意图________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,并且可与X的氢化物形成一种共价化合物。Y的离子半径是同周期主族元素中最小的,Z原子最外层电子数是其内层电子数的3/5,下列说法中一定正确的是
A. W的氧化物对应水化物为强酸,具有强氧化性。
B. 简单离子半径:Y<W<X<Z
C. 简单氢化物沸点:Z<X
D. 工业上一般采取电解Y的熔融氯化物来生产Y的单质
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氰酸(HCN)是一种剧毒类弱酸,具有苦杏仁气味,将其加水不断稀释,下列各量始终保持增大的是
A. Ka(HCN) B. c(H+) C. c(CN-)/c(HCN) D. C(HCN)/ c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. H2S溶于水的电离方程式为H2S![]() 2H++S2-,向H2S溶液中加入少量CuCl2固体,电离平衡正向移动
2H++S2-,向H2S溶液中加入少量CuCl2固体,电离平衡正向移动
B. KHSO4在熔融状态下的电离方程式为KHSO4 = K++H++SO42-,向醋酸中加入少量KHSO4固体,电离平衡逆向移动
C. 向稀氨水中滴加少量2mol/LNH4NO3,溶液,NH4+与OH- 结合生成NH3·H2O,使平衡正向移动,电离常数增大
D. 常温下,冰醋酸加水稀释的过程中,溶液的导电能力先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com