
科目: 来源: 题型:
【题目】克伦特罗是一种平喘药,但被违法添加在饲料中,俗称“瘦肉精”,其结构简式如图。下列有关“瘦肉精”的说法正确的是

A. 它的分子式为C12H17N2Cl2O
B. 它含有氨基、氯原子、碳碳双键等官能团
C. 1mol克伦特罗最多能和3 molH2发生加成反应
D. 一定条件下它能发生水解反应、酯化反应、消去反应、氧化反应、加聚反应等
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1.56×10-10。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B. 图中x点的坐标为(100,6)
C. 图中x点表示溶液中Ag+恰好完全沉淀
D. 把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图像在终点后变为虚线部分
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是

A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废催化剂含有SiO2、ZnO、CuS、ZnS、Fe3O4等物质,为落实“节约资源,变废为宝”的环保理念,某课外兴趣小组的同学取20g该物质进行实验,回收其中的Cu和Zn,实验方案如下:
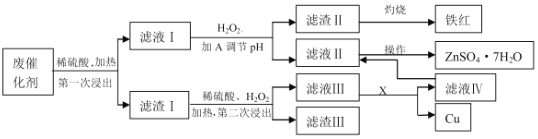
已知:ZnS可与稀硫酸反应;CuS不溶于稀硫酸,也不与其发生反应。请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是______溶液。

(2)滤液Ⅰ中的Fe2+最好用______来检验。
a.氯水 b.双氧水 c.KSCN溶液 d.K3[Fe(CN)6]溶液
(3)物质A是含有X元素的氧化物(XO),则X是______(填元素符号),由滤液Ⅱ、Ⅳ滤液获得ZnSO47H2O的操作是______________。
(4)第二次浸出时的化学方程式为_______________。
(5)加A调节溶液的pH约为______时,可以完全除去其中的杂质离子。
(当溶液中离子浓度小于等于10-5mol/L时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了5.74gZnSO47H2O晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)向K2CO3溶液中滴加酚酞,观察到的现象____________________,产生这种现象的原因是(用离子方程式回答)___________________________________________若将此溶液微热,观察到的现象________________________________,原因是__________________________________
(2)向K2CO3溶液中加入AlCl3溶液,反应的离子方程式是__________________________
(3)将K2CO3溶液蒸干得到的物质是______________________ 若将KHCO3溶液蒸干灼烧得到的物质是__________
查看答案和解析>>
科目: 来源: 题型:
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如图所示:
 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式__________________________。
(2)NaClO3的作用是___________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是_____;其使用的适宜pH范围是_____(填字母)。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分(C、D中溶液成份均过量)。
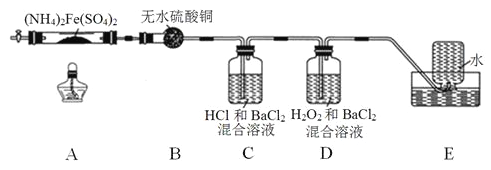
(1)B装置的作用是______________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有__________气体产生,写出D中发生反应的离子方程式___________________________________。若去掉C,是否能得出同样结论并解释其原因__________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,平均分成2份;_____ | _________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为___________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是
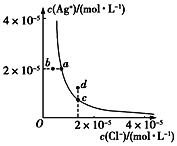
A. 加入AgNO3可以使溶液由c点变到d点
B. 加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C. d点有AgCl沉淀生成
D. a点对应的Ksp小于b点对应的Ksp
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________。
(2)X、Y、Z、W四种元素中,电负性最大的是_________(填元素符号,下同);同周期元素中,第一电高能介于Y和Z之间的有__________________。
(3)Y和W的氯化物熔点高的是______(填化学式),原因是_____________________;与Z的低价氯化物互为等电子体的离子是_______(填离子符号)。
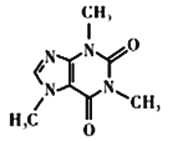
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的杂化类型有___________________。
(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____个WX,说明在形成晶体时,半径大的粒子先进行了_______方式的堆积,晶胞中距离W最近的X有_____个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com