
科目: 来源: 题型:
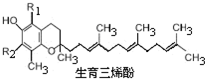 (2010?江苏一模)α,β,γ和δ四种生育三烯酚是构成维生素E的主要物质,下列叙述中不正确的是( ) (2010?江苏一模)α,β,γ和δ四种生育三烯酚是构成维生素E的主要物质,下列叙述中不正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
关于a克H2与b克He的下列说法正确的是( )。
A.同温同压下,H2与He的体积比为a:2b
B.同温同压下,若a=b,则H2和He物质的量比为2:1
C.体积相同时,He的质量一定大于H2
D.同温同压下,若二者的物质的量相等,其体积也相等
查看答案和解析>>
科目: 来源: 题型:
2- 7 |
2- 4 |
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
2- 4 |
2- 7 |
2- 7 |
2- 4 |
2- 7 |
2- 4 |
2- 7 |
2- 7 |
查看答案和解析>>
科目: 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com