
科目: 来源: 题型:
【题目】2009年3月1日,“嫦娥一号”卫星准确落于月球东经52.36°、南纬1.50°的预定撞击点。“嫦娥一号”担负的四大科学目标之一是探测下列元素的含量和分布情况:K、Th(钍)、U(铀)、O、Si、Mg、Al、Sb(锑)、Fe、Ti(钛)、Na、I、Cr(铬)、Gd(钆);其中属于主族元素的有( )
A. 7种 B. 8种 C. 9种 D. 10种
查看答案和解析>>
科目: 来源: 题型:
【题目】在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中错误的是( )
A. 加入含有NaOH的酚酞溶液,红色褪去,说明有H+存在
B. 加入有色布条后,有色布条退色,说明有HClO分子存在
C. 氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
D. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电于数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
(1)B在元素期表中的位置为_______,1个C原子核外有____个未成对的电子。
(2)D、E、F三种元素形成简单离子其半径由l大到小的顺序是_____________。(用离子符号表示)。
(3)写出D与C形成化合物的电子式______、_______。
(4)常温下,1molA的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为______________。
(5)非金属性的强弱:E_____F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因________________。
(6)Na2SO3可用作漂白织物时的去鼠剂。Na2SO3溶液及收Cl2后,溶液的酸性增强。写出该反应的离子方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____________________。
(3)已知:①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是___________________________________。
某同学认为,铝热反应可用于工业炼铁,你的判断是________(填“能”或“不能”),你的理由____________________________________。
(4)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃、101 KPa下:
①H2(g)+1/2O2(g)===H2O(g) ΔH1=-242 kJ/mol
②CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g)
ΔH2=-676 kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2二溴乙烷。其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴。可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。(夹持装置已略去)

有关数据列表如下:

填写下列空白:
(1)A的仪器名称是____。
(2)安全瓶B可以防止倒吸,还可以检查实验进行时导管是否发生堵塞。请写出发生堵塞时瓶B中的现象____。
(3)A中发生反应的化学方程式为:____;D中发生反应的化学方程式为:____。
(4)在装置C中应加入____(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)若产物中有少量副产物乙醚,可用___(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向1L pH=2的醋酸溶液中加入2L pH=2的盐酸,则混合溶液的pH约为(假设混合后溶液体积不变,室温下醋酸的电离平衡常数为1.8×10-5)
A. 2 B. 1.7 C. 2.3 D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】t ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1。已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数Kw=________________。
(2)该溶液中由水电离出的c(OH-)=_________________。
(3)该温度下,将NH3溶于水得100 mL 0.1 mol·L-1的氨水,测得pH=9,则该条件下,NH3· H2O的电离平衡常数Kb为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是一座开放的“元素大厦”,元素大厦尚未充满。若发现119号元素,请您在元素大厦中安排好它的“房间”
A. 第八周期第ⅠA族B. 第七周期第0族
C. 第七周期第ⅦA族D. 第六周期ⅡA族
查看答案和解析>>
科目: 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
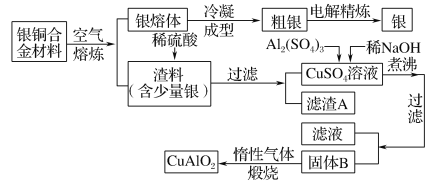
[注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃]
(1)电解精炼银时,阴极反应式为___________________________。
滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________________。
(2)固体混合物B的组成为________;
(3)完成煅烧过程中一个反应的化学方程式:__
________CuO+________Al2O3![]() ________CuAlO2+________。
________CuAlO2+________。
(4)CuSO4溶液也可用于制备胆矾,其基本操作是____________、过滤、洗涤和干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A. 在250 mL的容量瓶中定容配制250 mL烧碱溶液;
B. 用碱式滴定管移取25.00 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂;
C. 在天平上准确称取烧碱样品2.0 g,在烧杯中用蒸馏水溶解;
D. 将物质的量浓度为0.100 0 mol·L-1的标准盐酸装入酸式滴定管,调整液面记下开始读数为V1;
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2。
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写)
________→________→________→D→________。
(2)上述E中锥形瓶下垫一张白纸的作用是_______________________________
(3)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________。直到加入一滴盐酸后,溶液____________________________ (填颜色变化)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____________)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。

(6)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前 刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该烧碱的纯度____。(结果保留四位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com