
科目: 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应2SO2(g)+O2(g)![]() 2SO3(g),下列说法中能说明该反应已经达到化学平衡状态的是( )
2SO3(g),下列说法中能说明该反应已经达到化学平衡状态的是( )
A. SO2、O2、SO3同时存在
B. SO2、O2、SO3的物质的量浓度相等
C. SO2、O2、SO3的物质的量浓度不再改变
D. SO2的消耗速率等于SO3的生成速率
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(s)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的
2Z(g)一定达到化学平衡状态的
①容器中气体的密度不再发生变化 ②Y的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成2mol Z,同时消耗2mol Y
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是( )
A. 氯化氢的电子式:![]() B. 镁的原子结构示意图:
B. 镁的原子结构示意图:![]()
C. 乙烯的结构简式:CH2CH2 D. 碳酸钠的电离方程式:Na2CO3=Na++CO32一
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列填空。
(1)按以下实验方案可从海洋物质样品中提取具有抗肿瘤活性的天然产物。

则(1)、(2)、(3)、(4)的分离提纯方法依次为________、________、________、________。
(2)以下分离提纯方法不正确的是______(填字母)
A | B | C | D |
除去硝酸钾中混有的氯化钠 | 从溴单质的四氯化碳 溶液中提取出Br2 | 四氯化碳和水的分离 | 用自来水制取蒸馏水 |
重结晶 | 萃取 | 蒸馏 | 蒸馏 |
(3)下列物质保存方法正确的是______(填字母)
A | B | C | D |
|
|
|
|
(④) | (⑤) | (②⑥) | ( ①③) |
①NaOH溶液 ②浓硫酸 ③Na2CO3溶液 ④白磷 ⑤硝酸银溶液 ⑥酒精
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用,根据题意回答下列问题:
I工业上制备Na2S的反应原理如下
①Na2SO4(s)===Na2S(s)+2O2(g) △H1=+1011.0kJ·mol-1
②C(s)+O2(g)===CO2(g) △H2=-393.5kJ·mol-1
③2C(s)+O2(g)===2CO(g) △H3=-221.0kJ·mol-1
④Na2SO4(s)+4C(s)===Na2S(s)+4CO(g) △H4
(1)△H4=___________ kJ·mol-1。
(2)反应④能自发进行的条件是___________。
(3)工业上制备Na2S不用反应①,而用反应④的理由是_____________________________。
Ⅱ.在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生反应:2NO(g)+2C0(g) ![]() 2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
时间(s) | 0 | 10 | 20 | 30 | 40 | …… |
C(NO)/mol/L | 0.100 | 0.050 | 0.025 | 0.010 | 0.010 | …… |
(1)计算此温度下该反应的K=______________________。
(2)达到平衡时,下列措施能提高NO转化率的是___________(填序号)。
A.选用更有效的催化剂
B.降低反应体系的温度
C.充入氩气使容器内压强增大
D.充入CO使容器内压强增大
Ⅲ.工业上常用臭氧处理含NO2-的废水。
(1)O3氧化NO2-可产生NO3-和O2,反应中每生成1mol的O2转移___________mol电子。
(2)O3可由电解稀硝酸制得,原理如图。图中阴极为___________(填“A”或“B”),阳极(惰性电极)的电极反应式为____________________________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,Ksp(CaF2)=4×10-9,Ksp(CaSO4)=9.1×10-6。取一定量的CaF2固体溶于水,溶液中离子浓度的变化与时间的变化关系如图所示。下列有关说法正确的是

A. M点表示CaF2的不饱和溶液
B. 常温下,CaF2的饱和溶液中,c(F-)=10-3mol/L
C. 温度不变,t时刻改变的条件可能是向溶液中加了KF固体,CaF2的Ksp增大
D. 常温下,向100 mL CaF2的饱和溶液中加人10mL0.2mol/LNa2SO4溶液,平衡后溶液中的c(Ca2+)约为9.1×10-4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
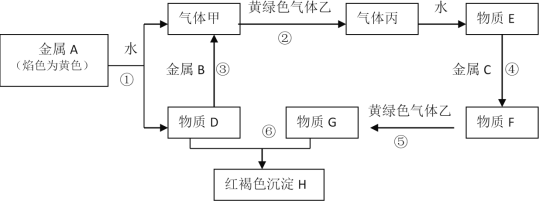
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A___、 B___、C___、F___、H___、乙___。
(2)写出下列反应化学方程式:
反应⑤____。
反应⑥____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了利用氯酸钾分解制O2测定标准状况下气体摩尔体积的探究实验。
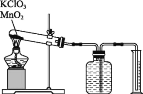
实验步骤如下:①连接好实验装置,检查装置的气密性。②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95g。③加热,开始反应,直到不再有气体产生为止。④测量排入量筒中水的体积为285.0mL,换算成标准状况下氧气的体积为279.7mL。⑤准确称量试管和残留物的质量为15.55g。根据上述实验过程,回答下列问题。
(1)如何检查装置的气密性?________。
(2)以下是测量收集到的气体体积必须包括的几个步骤:①使试管和广口瓶内气体都冷却至室温;②_____;③读取量筒内液体的体积。进行③的实验操作时,若仰视读数,则读取氧气的体积__ (填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是______mol;实验测得标准状况下氧气的摩尔体积是__ (保留小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com